题目内容
20.温度为T0时,在恒容的密闭容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )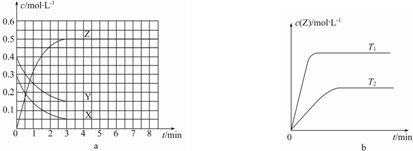
| A. | 该反应的正反应是放热反应 | |
| B. | 若在第6 min时升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 反应中某时刻各物质的正反应速率为2v(X)═2v(Y)═v(Z) |
分析 根据图a知,X、Y是反应物而Z是生成物,
A.图b中,根据“先拐先平数值大”知,T1>T2,升高温度,Z的含量增大,说明平衡正向移动,升高温度平衡向吸热反应方向移动;
B.该反应的正反应是吸热反应,升高温度,正逆反应速率都增大,平衡正向移动;
C.转化率=参加反应的浓度变化量反应初始浓度×100;
D.参加反应的△c(X)=(0.3-0.05)mol/L=0.25mol/L、△c(Y)=(0.4-0.15)mol/L=0.25mol/L、△c(Z)=(0.5-0)mol/L=0.5mol/L,同一反应同一时间段内各物质的浓度变化量之比等于反应速率之比.
解答 解:根据图a知,X、Y是反应物而Z是生成物,
A.图b中,根据“先拐先平数值大”知,T1>T2,升高温度平衡向吸热反应方向移动,升高温度,Z的含量增大,说明平衡正向移动,所以正反应是吸热反应,故A错误;
B.该反应的正反应是吸热反应,升高温度,正逆反应速率都增大,但正反应速率增大程度大于逆反应速率,所以平衡正向移动,故B错误;
C.转化率=参加反应的浓度变化量反应初始浓度×100=(0.4−0.15)mol/L0.4mol/L×100=62.5%,故C错误;
D.参加反应的△c(X)=(0.3-0.05)mol/L=0.25mol/L、△c(Y)=(0.4-0.15)mol/L=0.25mol/L、△c(Z)=(0.5-0)mol/L=0.5mol/L,同一反应同一时间段内各物质的浓度变化量之比等于其反应速率之比,所以X、Y、Z的反应速率之比=0.25mol/L:0.25mol/L:0.5mol/L=1:1:2,即反应中某时刻各物质的正反应速率为2v(X)═2v(Y)═v(Z),故D正确;
故选D.
点评 本题以图象分析为载体考查化学平衡计算,侧重考查学生分析计算能力,根据“先拐先平数值大”判断温度高低从而确定反应热,知道反应中各物质反应速率与计算数的关系,题目难度不大.

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案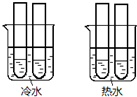 乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:
乙二酸俗称草酸是一种二元弱酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示)填空:| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
(2)KHC2O4溶液显酸性的原因是HC2O4-的电离程度大于水解程度向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是AD
A.c(K+)═c(HC2O4-)+c(H2C2O4)+c(C2O42-) B.c(Na+)═c(H2C2O4)+c(C2O42-)
C.c(K+)+c(Na+)═c(HC2O4-)+c(C2O42-) D.c(K+)>c(Na+)
(3)H2C2O4与酸性高锰酸钾溶液反应,现象是有气泡(CO2)产生,紫色消失.写出反应的离子方程式2MnO4-+5H2C2O4+6H+→2Mn2++10CO2↑+8H2O又知该反应开始时速率较慢,随后大大加快,可能的原因是生成的Mn2+对该反应具有催化作用
(4)某同学设计实验如图所示:两个烧杯中的试管都分别盛有2ml0.1mol/LH2C2O4溶液和4mL 0.1mol/L 酸性KMnO4溶液,分别混合并振荡,记录溶液褪色所需时间.该实验目的是研究温度对反应速率的影响,但该实验始终没有看到溶液褪色,推测原因KMnO4溶液过量.
| A. | 苯 | B. | 乙酸 | C. | 乙烷 | D. | 油脂 |
| A. | 暴雨后遭洪水浸泡的铁门生锈是因为发生化学腐蚀 | |
| B. | 白铁皮(铁镀锌)表面有划损时,不能阻止铁被腐蚀 | |
| C. | 废弃的干电池不能随意丢弃,但可以土埋处理 | |
| D. | 不能将铁制自来水管与铜制水龙头连接 |
| A. | 二氧化硫不能使溴水、高锰酸钾溶液迅速褪色 | |
| B. | 接触法制硫酸的沸腾炉排出的炉气中含SO2 | |
| C. | 实验室可用启普发生器制取二氧化硫 | |
| D. | 用石灰水很容易区分二氧化碳和二氧化硫 |
| A. |  异戊烷 异戊烷 | B. | 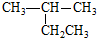 2-甲基丁烷 2-甲基丁烷 | C. |  间二甲苯 间二甲苯 | D. |  2-甲基-4-丁醇 |
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2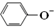 +H2O+CO2→2 +H2O+CO2→2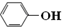 +CO32- +CO32- | |
| C. | 丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3催化剂→  | |
| D. | 乙醛溶液与足量的银氨溶液共热的化学方程式:CH3CHO+2Ag(NH3)2OH△→CH3COONH4+2Ag↓+3NH3+H2O? |
 ,A分子中处于同一平面的原子最多有16个;
,A分子中处于同一平面的原子最多有16个;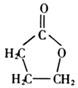 :
: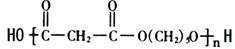 .
.