题目内容
10.NaCl是价廉且应用广泛的化工业原料,例如,纯碱工业、氯碱工业、氯酸钾工业、肥皂工业等.(1)19世纪60年代氨碱法是纯碱工业广泛使用的方法,20世纪20年代以后被联合制碱法逐渐取代.
①请写出以NaCl为原料利用氨碱法生产纯碱的化学方程式NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3△_ Na2CO3+CO2↑+H2O;
②在联合制碱法中,纯碱工厂与合成氨工厂进行联合生产,以方便的获得原料NH3、CO2;
③在联合制碱法中循环使用,而在氨碱法中循环使用率不高的物质是CO2 NaCl.
(2)氯酸钾是重要的化工业产品,在火柴、炸药、雷管、焰火等制造中有重要应用,工业中首先通过电解热食盐水制得氯酸钠,再加入一定量的氯化钾即可得到氯酸钾沉淀.
①在火柴、炸药、雷管、焰火的制造过程中大量使用氯酸钾,主要应用氯酸钾的强氧化性;
②请写出电解食盐水生产氯酸钠的化学方程式NaCl+3H2O通电_NaClO3+3H2↑,该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有需要加热恒温控制、没有离子交换膜(请答出两点);
(3)在肥皂的工业生成过程中,也要使用NaCl的目的是加入食盐使肥皂析出.
分析 (1)①根据制取纯碱的原理:向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱;
②联碱法是以食盐、氨和二氧化碳(其中二氧化碳来自合成氨厂用水煤气制取氢气时的废气)为原料来制取纯碱;
③联合制碱法循环物质:氯化钠,二氧化碳,而在氨碱法中循环使用率不高;
(2)①氯酸钾中氯元素的化合价为+5价,反应中元素化合价降低,具有强氧化性;
②根据NaCl做还原剂,H2O作氧化剂分析解答;该工艺过程中使用的装置与氯碱工业中使用的装置主要区别有无离子交换膜,需要加热恒温;
(3)制肥皂时,反应后加食盐,通过盐析使肥皂析出.
解答 解:(1)①氨气溶于水所得氨水呈碱性,比水更易吸收二氧化碳;向饱和的氯化钠溶液中依次通入氨气、二氧化碳,析出碳酸氢钠晶体,加热碳酸氢钠晶体可制得纯碱,上述反应的化学方程式分别为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3,2NaHCO3△_Na2CO3+CO2↑+H2O,
故答案为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,2NaHCO3△_Na2CO3+CO2↑+H2O;
②在联合制碱法中,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,放出的二氧化碳气体可回收循环使用,其滤液是含有氯化铵和氯化钠的溶液,第二个过程是从含有氯化铵和氯化钠的滤液中结晶沉淀出氯化铵晶体,在低温条件下,向滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品,纯碱工厂与合成氨工厂进行联合生产,以便获得原料NH3、CO2,
故答案为:合成氨;NH3、CO2;
③氨碱法的最大缺点在于原料食盐的利用率只有72%~74%,联合制碱法最大的优点是使食盐的利用率提高到96%以上,此外氨碱法与联合制碱法相比,CO2循环使用率也不高,
故答案为:CO2;NaCl;
(2)①处于高价的元素具有氧化性,氯酸钾中氯元素的化合价为+5价,在火柴、炸药、雷管、焰火的制造过程中分解生成氯化钾和氧气,氯元素化合价降低,表现强氧化性,
故答案为:强氧化;
②化合价升高的氯元素被氧化,化合价由-1价升高到+5价,化合价降低的氢元素被还原,化合价由+1价降低到0价,根据氧化还原反应得失电子数相等,反应为:NaCl+3H2O通电_NaClO3+3H2↑,需要加热恒温控制、没有离子交换膜,
故答案为:NaCl+3H2O通电_NaClO3+3H2↑,需要加热恒温控制、没有离子交换膜;
(3)工业上制肥皂时,为了使肥皂和甘油充分分离,常向皂化锅中慢慢加入食盐颗粒,将高级脂肪酸钠从混合液中析出,
故答案为:加入食盐使肥皂析出.
点评 本题主要考查了氨碱法(索氏)和联合制碱法(侯氏)的原理、氯酸钾的性质、盐析等知识,掌握原理是解题的关键,题目难度中等.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| A. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═CO2↑+2H2O | |
| D. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| A. | 己烷(己烯):加入溴水,分液 | B. | 硝酸钾(氯化钠):浓溶液降温结晶 | ||
| C. | Fe3+(Al3+)):过量的氨水,过滤 | D. | CO2(CO):点燃 |
| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收546.6 kJ热量 | |
| B. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于546.6 kJ | |
| C. | 相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比1 mol H-H键和1 mol F-F 键的键能之和大546.6 kJ |
| A. | 二氧化硫不能使溴水、高锰酸钾溶液迅速褪色 | |
| B. | 接触法制硫酸的沸腾炉排出的炉气中含SO2 | |
| C. | 实验室可用启普发生器制取二氧化硫 | |
| D. | 用石灰水很容易区分二氧化碳和二氧化硫 |
| A. | 向10ml 0.1mol•L-1NH4HSO4溶液中滴加10ml 0.1mol•L-1NaOH溶液:2c(SO42-)═c(NH4+)+c(NH3•H2O) | |
| B. | 等体积等浓度NaHCO3溶液和Na2CO3溶液混合:C(HCO−3)C(H2CO3)<C(CO2−3)C(HCO−3) | |
| C. | 物质的量浓度均为0.1mol•L-1Na2S溶液、NaHS溶液等体积混合所得溶液中:2c(OH--)-2c(H+)═3 c(H2S)+c(HS--)-c(S2--) | |
| D. | 将足量的AgCl分别放入:①5 ml水 ②10 ml 0.2mol•L-1MgCl2溶液③20ml0.3mol•L-1盐酸中溶解至饱和,c(Ag+):①>②>③ |
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2H+-2e-═H2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+ | |
| D. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
| A. | X有多种气态氢化物 | B. | 原子半径:R>W | ||
| C. | 气态氢化物的热稳定性:R>Y | D. | 最高价氧化物的水化物的酸性:X>R |
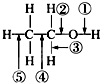 乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )| A. | 和金属钠反应时①键断裂 | |
| B. | 和乙酸发生酯化反应时②键断裂 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |