题目内容
17.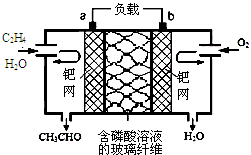 乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.
乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.| A. | 该电池可以实现化学能和电能的相互转化 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 正极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 每有1mol 乙烯反应,则迁移2 mol H+ |
分析 根据电池反应式知,该反应中O元素化合价由0价变为-2价而发生还原反应,所以通入氧气的电极是正极、通入乙烯的电极是负极,
A.该装置没有未接电源,所以不能将电能转化为化学能;
B.放电时,电子从负极沿导线流向正极;
C.电解质溶液呈酸性,所以正极上氧气得电子和氢离子反应生成水;
D.每有1mol 乙烯反应,转移电子数是2mol,结合正极反应式判断.
解答 解:根据电池反应式知,该反应中O元素化合价由0价变为-2价而发生还原反应,所以通入氧气的电极是正极、通入乙烯的电极是负极,
A.该装置没有未接电源,所以不能将电能转化为化学能,所以不能实现化学能和电能的相互转化,故A错误;
B.放电时,电子从负极沿导线流向正极,通入乙烯的电极a是负极、通入氧化剂的电极b是正极,电子移动方向:电极a→负载→电极b,故B错误;
C.电解质溶液呈酸性,所以正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O,故C错误;
D.每有1mol 乙烯反应,转移电子数是2mol,结合正极反应式O2+4e-+4H+=2H2O知,有2mol氢离子迁移,故D正确;
故选D.
点评 本题考查化学电源新型电池,为高频考点,明确燃料电池正负极的判断、电子流向、电极反应式的书写即可解答,难点是电极反应式的书写,要结合电解质溶液酸碱性酸性,易错选项是B,注意电子不能进入溶液,溶液中通过离子定向移动形成电流.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
7.主族元素X、Y、Z的常见离子为aX+、bY2-、cZ-,半径大小关系是X+<Z-<Y2-下列说法不正确的是( )
| A. | b一定小于c | B. | 单质的氧化性Z>Y | ||
| C. | Y2-的还原性大于Z- | D. | X、Y可处于同周期或X在Y的下周期 |
8.下列物质能够使酸性高锰酸钾褪色的是( )
| A. | 苯 | B. | 乙酸 | C. | 乙烷 | D. | 油脂 |
5.有关二氧化硫的叙述正确的是( )
| A. | 二氧化硫不能使溴水、高锰酸钾溶液迅速褪色 | |
| B. | 接触法制硫酸的沸腾炉排出的炉气中含SO2 | |
| C. | 实验室可用启普发生器制取二氧化硫 | |
| D. | 用石灰水很容易区分二氧化碳和二氧化硫 |
2.下列关于电化学原理应用中,正确的是( )
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2H+-2e-═H2↑ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+ | |
| D. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
9.下列物质的名称正确的是( )
| A. |  异戊烷 异戊烷 | B. | 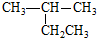 2-甲基丁烷 2-甲基丁烷 | C. |  间二甲苯 间二甲苯 | D. |  2-甲基-4-丁醇 |
7.利用原电池原理可以探究金属的活动性.
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |

