题目内容
15.有下列两个反应.当温度降低时.反应a平衡右移.反应b平衡左移.a、C2H2(g)+H2(g)?C2H4(g)
b、2CH4(g)?C2H4(g)+2H2(g)
报据上述变化.判断以下几个热化学方程式:
①C(s)+2H2(g)?CH4(g)△H=-Q1 kJ•mol-1
②2C(s)+H2(g)?C2H2(g)△H=-Q2 kJ•mol-1
③2C(s)+2H2(g)?C2H4(g)△H=-Q3 kJ•mol-1
其中2Q1、Q2、Q3,从大到小的顺序是( )
| A. | 2Q1>Q3>Q2 | B. | Q3>Q2>2Q1 | C. | Q2>Q3>2Q1 | D. | Q3>2Q1>Q2 |
分析 先根据温度变化,平衡移动判断反应a、反应b的热效应,然后利用盖斯定律判断.
解答 解:当温度降低时,反应a的平衡向正反应方向移动,说明该反应正向为放热反应,△H<0,反应b的平衡向逆反应方向移动,说明该反应正向为吸热反应,△H>0,
(1)C(s)+2H2(g)?CH4(g)△H=-Q1 kJ/mol
(2)2C(s)+H2(g)?C2H2(g)△H=-Q2 kJ/mol
(3)2C(s)+2H2(g)?C2H4(g)△H=-Q3 kJ/mol
利用盖斯定律,(3)-(2),得到C2H2(g)+H2(g)?C2H4(g)△H=Q2-Q3,与题干中的a中的方程式一样,而a中的反应为放热反应,则Q2-Q3<0,所以Q2<Q3;
同理:(3)-(1)×2,得到2CH4(g)?C2H4(g)+2H2(g)△H=2Q1-Q3,与题干中的b中的方程式一样,而b中的反应为吸热反应,则2Q1-Q3>0,所以2Q1>Q3;
综上所述2Q1>Q3>Q2
故选:A.
点评 本题主要考查了盖斯定律的运用,难度不大,根据所学知识即可完成.

练习册系列答案
相关题目
6.恒容密闭容器中进行的可逆反应2NO2?2NO+O2,不能说明达到平衡状态的是( )
| A. | 单位时间内生成a mo1 O2的同时生成2a mol NO2 | |
| B. | 单位时间内生成a mol O2的同时生成2a mol NO | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的压强不再改变 |
3.NA代表阿伏加德常数,下列说法正确的是( )
| A. | 0.1mol/L Na2CO3溶液中含有0.2molNa+ | |
| B. | 在常温常压下,11.2L氮气所含的原子数目为NA | |
| C. | 2g氢气所含原子数目为NA | |
| D. | 在常温常压下,18 g水中含有的分子数为NA |
7.下列离子方程式书写正确的是( )
| A. | 稀硫酸滴到铁片上:Fe+H+═Fe2++H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2↓ | |
| C. | 碳酸钠溶液与稀盐酸反应:CO32-+2H+═H2CO3 | |
| D. | 碳酸氢钠溶液与盐酸混合:HCO3-+H+═H2O+CO2↑ |
5. 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液..
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
(1)滴定达到终点的现是加入最后一滴氢氧化钠溶液,溶液由无色恰好变成浅红色,且半分钟内不褪色;
此时锥形瓶内溶液的pH的范围是8.2~10.
(2)根据上述数据,可计算出该盐酸的浓度为0.11mol/L.
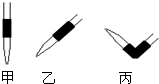
(3)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有C
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
F.用于配制标准溶液的NaOH固体中含有少量Na2CO3.
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:步骤一:配制100mL 0.10mol/L NaOH标准溶液..
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如下.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |
此时锥形瓶内溶液的pH的范围是8.2~10.
(2)根据上述数据,可计算出该盐酸的浓度为0.11mol/L.
(3)排去碱式滴定管中气泡的方法应采用如图的丙操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液.
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果(待测液浓度值)偏低的有C
A.配制标准溶液定容时,加水超过刻度
B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸溶液润洗
D.滴定到达终点时,仰视读出滴定管读数
E.碱式滴定管尖嘴部分有气泡,滴定后消失
F.用于配制标准溶液的NaOH固体中含有少量Na2CO3.

 通过以下路线可合成(Ⅱ):
通过以下路线可合成(Ⅱ): $→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ)
$→_{△}^{浓H_{2}SO_{4}}$C3H4O2(Ⅲ)$\stackrel{C_{2}H_{5}OH/H+}{→}$C5H8O2$→_{一定条件}^{HBr}$(Ⅱ) .
. ,反应类型是酯化反应(或取代反应).
,反应类型是酯化反应(或取代反应). .
.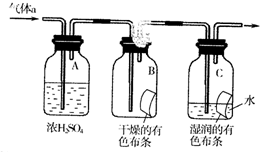 氯气是一种化学性质活泼的非金属单质,工业上
氯气是一种化学性质活泼的非金属单质,工业上