题目内容
4.为防治碘缺乏病,通常在食盐中添加少量的KIO3.其反应 为:KIO3+5KI+3H2SO4═3I2+3K2SO4+3H2O(1)求当有3mol的I2生成时,有多少mol还原剂被氧化?
(2)当有1mol 氧化剂参加反应时,转移电子的物质的量为多少mol?
分析 KIO3+5KI+3H2SO4═3I2+3K2SO4+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,该反应中转移5e-,以此来解答.
解答 解:(1)由KIO3+5KI+3H2SO4═3I2+3K2SO4+3H2O可知,化学计量数之比等于物质的量比,则有3mol的I2生成时,5molKI作还原剂被氧化,
答:当有3mol的I2生成时,有5mol还原剂被氧化;
(2)KIO3为氧化剂,有1mol 氧化剂参加反应时,转移电子的物质的量为1mol×(5-0)=5mol,
答:当有1mol 氧化剂参加反应时,转移电子的物质的量为5mol.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
14.下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是( )
| A. | 可燃性气体的验纯 | |
| B. | 实验剩余的药品不能放回原试剂瓶 | |
| C. | 滴管不能交叉使用 | |
| D. | 气体实验装置在实验前进行气密性检查 |
15.有下列两个反应.当温度降低时.反应a平衡右移.反应b平衡左移.
a、C2H2(g)+H2(g)?C2H4(g)
b、2CH4(g)?C2H4(g)+2H2(g)
报据上述变化.判断以下几个热化学方程式:
①C(s)+2H2(g)?CH4(g)△H=-Q1 kJ•mol-1
②2C(s)+H2(g)?C2H2(g)△H=-Q2 kJ•mol-1
③2C(s)+2H2(g)?C2H4(g)△H=-Q3 kJ•mol-1
其中2Q1、Q2、Q3,从大到小的顺序是( )
a、C2H2(g)+H2(g)?C2H4(g)
b、2CH4(g)?C2H4(g)+2H2(g)
报据上述变化.判断以下几个热化学方程式:
①C(s)+2H2(g)?CH4(g)△H=-Q1 kJ•mol-1
②2C(s)+H2(g)?C2H2(g)△H=-Q2 kJ•mol-1
③2C(s)+2H2(g)?C2H4(g)△H=-Q3 kJ•mol-1
其中2Q1、Q2、Q3,从大到小的顺序是( )
| A. | 2Q1>Q3>Q2 | B. | Q3>Q2>2Q1 | C. | Q2>Q3>2Q1 | D. | Q3>2Q1>Q2 |
16.下列实验中,所采用的分离或提纯与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离氯化钠和碘的固体混合物 | 加热法 | 碘单质易升华 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去NaOH溶液中的Na2SO4 | 加适量的BaCl2后过滤 | BaSO4难溶 |
| A. | A | B. | B | C. | C | D. | D |
13.配制一定体积,一定物质的量浓度溶液时,下列情况中溶液的浓度偏小的是( )
| A. | 溶解后,溶液未经冷却,立即转移至容量瓶 | |
| B. | 胶头滴管滴加蒸馏水时,不小心把少量的蒸馏水滴到容量瓶外 | |
| C. | 转移溶液后,未洗涤烧杯和玻璃棒就直接定容 | |
| D. | 定容时,俯视刻度线 |
14.下列变化中,属于吸热反应的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 氧化钙溶于水 |
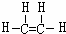 ,B中官能团的电子式为
,B中官能团的电子式为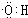 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.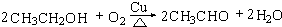 .
.