题目内容
7.下列离子方程式书写正确的是( )| A. | 稀硫酸滴到铁片上:Fe+H+═Fe2++H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2↓ | |
| C. | 碳酸钠溶液与稀盐酸反应:CO32-+2H+═H2CO3 | |
| D. | 碳酸氢钠溶液与盐酸混合:HCO3-+H+═H2O+CO2↑ |
分析 A.该离子方程式两边氢元素质量不守恒,正电荷不相等,违反了质量守恒、电荷守恒;
B.硫酸铜为易溶的强电解质,离子方程式中硫酸铜应该拆开;
C.碳酸钠与稀盐酸反应生成氯化钠、二氧化碳气体和水,碳酸应该拆开,写成二氧化碳和水的形式;
D.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳气体和水.
解答 解:A.稀硫酸滴到铁片上生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.硫酸铜与氢氧化钠溶液反应生成硫酸钠和氢氧化铜,正确的离子方程式为:Cu2++2OH-═Cu(OH)2↓,故B错误;
C.碳酸钠溶液与稀盐酸反应生成二氧化碳气体和水,正确的离子方程式为:CO32-+2H+═H2O+CO2↑,故C错误;
D.碳酸氢钠溶液与盐酸反应生成氯化钠、二氧化碳气体和水,反应的离子方程式为:HCO3-+H+═H2O+CO2↑,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
15.有下列两个反应.当温度降低时.反应a平衡右移.反应b平衡左移.
a、C2H2(g)+H2(g)?C2H4(g)
b、2CH4(g)?C2H4(g)+2H2(g)
报据上述变化.判断以下几个热化学方程式:
①C(s)+2H2(g)?CH4(g)△H=-Q1 kJ•mol-1
②2C(s)+H2(g)?C2H2(g)△H=-Q2 kJ•mol-1
③2C(s)+2H2(g)?C2H4(g)△H=-Q3 kJ•mol-1
其中2Q1、Q2、Q3,从大到小的顺序是( )
a、C2H2(g)+H2(g)?C2H4(g)
b、2CH4(g)?C2H4(g)+2H2(g)
报据上述变化.判断以下几个热化学方程式:
①C(s)+2H2(g)?CH4(g)△H=-Q1 kJ•mol-1
②2C(s)+H2(g)?C2H2(g)△H=-Q2 kJ•mol-1
③2C(s)+2H2(g)?C2H4(g)△H=-Q3 kJ•mol-1
其中2Q1、Q2、Q3,从大到小的顺序是( )
| A. | 2Q1>Q3>Q2 | B. | Q3>Q2>2Q1 | C. | Q2>Q3>2Q1 | D. | Q3>2Q1>Q2 |
16.下列实验中,所采用的分离或提纯与对应原理都正确的是( )
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离氯化钠和碘的固体混合物 | 加热法 | 碘单质易升华 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去NaOH溶液中的Na2SO4 | 加适量的BaCl2后过滤 | BaSO4难溶 |
| A. | A | B. | B | C. | C | D. | D |

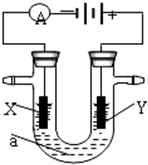 变”)
变”)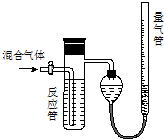
 回答下列问题:
回答下列问题: