题目内容
20.钢铁很容易生锈而被腐蚀.每年因腐蚀而损失的铜材占世界钢铁年产量的四分之一.
(l)用铁腐蚀主要是吸氧腐蚀.该腐蚀过程中的电极反应式为负极:Fe=Fe2++2e-,正极:2H2O+O2+4e-=4OH-;.
(2)为了降低某水库的铁闸门被腐蚀的速率.可以采用图甲所示的方案.其中焊接在铁闸门上的固体材料R可以采用c(填序号).
a.铜 b.钠 c.锌 d.石墨
(3)图乙所示的方案也可以降低铁闸门的腐蚀速率.其中铁闸门应该连接在直流电原的负极.
(4)在实际生产中.可在铁件的表面镀铜防止铁被腐蚀.装置示意如图丙:
①通常情况下A电极对应的金属铜(写元素名称).B电极的电极反应是Cu2++2e-═Cu.
②若电镀前A、B两金属片质量相同.电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为0.08mol.
③镀层破损后.镀铜铁比镀锌铁更容昌被腐蚀.请简要说明原因铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
分析 (1)铁为活泼金属,易发生电化学腐蚀,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应;
(2)原电池的负极金属易被腐蚀,根据原电池的工作原理来回答;
(3)在电解池的阴极上的金属被保护,根据电解池的工作原理来回答;
(4)①电镀时,镀层作阳极,镀件作阴极,阴极上得电子发生还原反应;
②阳极上铜失电子发生氧化反应,阴极上铜离子得电子发生还原反应,若电镀前铁、铜两片金属质量相同,电镀完成后二者质量差为5.12g,二者质量差的一半为阴极析出的铜,根据铜和转移电子之间的关系式计算;
③作原电池负极的铁易被腐蚀,作原电池正极的铁被保护.
解答 解:(1)钢铁发生吸氧腐蚀时,铁作负极,发生失电子的氧化反应,即Fe=Fe2++2e-,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:负极:Fe=Fe2++2e-,正极:2H2O+O2+4e-=4OH-;
(2)为了降低某水库的铁闸门被腐蚀的速率,可以让金属铁做原电池的正极,其中焊接在铁闸门上的固体材料R可以是比金属铁的活泼性强的金属,钾钙钠都不能做电极材料,故答案为:c;
(3)电解池的阴极上的金属被保护,为降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的负极,故答案为:负;
(4)①电镀时,镀层铜作阳极,镀件铁作阴极,所以A是铜,B是铁,阴极上铜离子得电子生成铜,电极反应式为Cu2++2e-═Cu,
故答案为:铜;Cu2++2e-═Cu;
②阳极上铜失电子发生氧化反应,阴极上铜离子得电子发生还原反应,若电镀前铁、铜两片金属质量相同,电镀完成后二者质量差为5.12g,二者质量差的一半为阴极析出的铜,则转移电子的物质的量=$\frac{\frac{5.12g}{2}}{64g/mol}$=0.08mol,
故答案为:0.08;
③锌、铁和电解质溶液构成原电池时,锌易失电子作负极,铁作正极被保护,铜、铁和电解质溶液构成原电池时,铁易失电子作负极被腐蚀,所以镀铜铁比镀锌铁更容易被腐蚀,
故答案为:铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,知道作原电池负极和电解池阳极的金属易被腐蚀,难度不大.

检测水中的NO2-可用比色法,其步骤是:
a.配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液
b.配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对
苯磺酸粉末,实验结果如下表所示:
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
请填写以下空白:
①比色法的基本依据是溶液颜色的深浅与浓度的大小成正比;
②若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为1.00mg/L.
③用NaNO2直接配制溶液B的缺点是由②计算可知,1L溶液B中只含NO2-1mg,不易称量,直接配溶液B时误差大.
④如果水样显色后比6号还深,应采取的措施是将水样先稀释一定倍数后再重复实验.
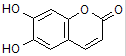
| A. | M的相对分子质量是180 | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1 mol M与足量NaHCO3反应能生成2 mol CO2 |
| A. | KSCN溶液 | B. | BaCl2溶液 | C. | 酸性KMnO4溶液 | D. | 盐酸 |
a、C2H2(g)+H2(g)?C2H4(g)
b、2CH4(g)?C2H4(g)+2H2(g)
报据上述变化.判断以下几个热化学方程式:
①C(s)+2H2(g)?CH4(g)△H=-Q1 kJ•mol-1
②2C(s)+H2(g)?C2H2(g)△H=-Q2 kJ•mol-1
③2C(s)+2H2(g)?C2H4(g)△H=-Q3 kJ•mol-1
其中2Q1、Q2、Q3,从大到小的顺序是( )
| A. | 2Q1>Q3>Q2 | B. | Q3>Q2>2Q1 | C. | Q2>Q3>2Q1 | D. | Q3>2Q1>Q2 |
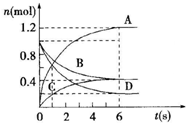 一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为3B+4D═6A+2C | |
| B. | 反应进行到6s时v(B)=v(C) | |
| C. | 反应进行到6s时,用B表示的平均反应速率为0.05mol•L-1•s-1 | |
| D. | 反应进行到6s时,反应停止了 |
| A. | 该反应中铜单质在反应过程中得到电子 | |
| B. | 该反应中浓硝酸被氧化 | |
| C. | 该反应中硝酸只表现氧化性 | |
| D. | 该反应中浓硝酸是氧化剂 |
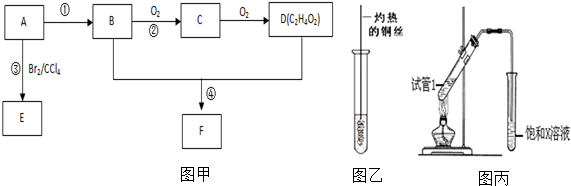
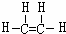 ,B中官能团的电子式为
,B中官能团的电子式为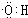 ,D中官能团的名称为羧基.
,D中官能团的名称为羧基.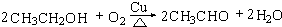 .
.