题目内容
10. 氯气是一种化学性质活泼的非金属单质,工业上
氯气是一种化学性质活泼的非金属单质,工业上可用氯气制取漂白粉、有机溶剂等.
(1)实验室中所用少量氯气常用下列方法制取:
4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2+MnCl2+2H2O2.试回答下列问题:
①请将上述反应改写成离子方程式:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
②反应中盐酸的作用是酸性和还原性.
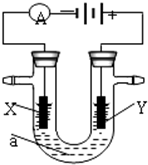
(2)甲同学没计如图所示装置研究氯气能否与水发生反应.气体a是含有少量空气和水蒸气的氯气.请回答下列问题:
①浓硫酸的作用是除去氯气中的水蒸气或干燥氯气.
②证明氯气和水反应的实验现象为装置B中的有色布条不褪色.装置C中的有色布条褪色,反应的化学方程式是Cl2+H2O?HCl+HClO.
③实验室中多余氯气一般用氢氧化钠溶液吸收,发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
④工业上将氯气通入石灰乳[Ca(0H)2]中可制取漂白粉,反应的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.漂白粉溶于水后,遇到空气中的CO2,即产生漂白、杀菌作用,写出反应的化学方程式是Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
分析 (1)①用实际参加反应的离子符号来表示离子反应的式子,在离子反应方程式中单质、气体、水应保留化学式;
②反应中盐酸中一部分氯的化合价升高,还有一部分氯的化合价不变,所以盐酸既是酸又是还原剂;
(2)①浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体中的水的作用;
②干燥氯气不具有漂白性,次氯酸具有漂白性;
③实验室用氢氧化钠溶液吸收多余的Cl2,生成氯化钠和次氯酸钠,所以离子反应为Cl2+2OH-=Cl-+ClO-+H2O;
④氯气在碱性条件下自身发生氧化还原反应,可与石灰乳反应生成氯化钙和次氯酸钙,置露在空气的漂白粉与二氧化碳、水的反应生成具有漂白作用的次氯酸;
解答 解:(1)①在4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2+MnCl2+2H2O中,浓盐酸是强酸,氯化锰是盐是强电解质,都是易溶易电离的物质,拆成离子的形式,所以离子方程式为:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O,故答案为:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O;
②反应中盐酸中一部分氯的化合价升高,还有一部分氯的化合价不变,所以盐酸既是酸又是还原剂,故答案为:酸性和还原性;
(2)①制得的氯气中含有水蒸气,需要用浓硫酸干燥,所以浓硫酸的作用是除去氯气中的水蒸气,干燥氯气;
故答案为:除去氯气中的水蒸气或干燥氯气;
②干燥氯气不具有漂白性,氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O?HCl+HClO,次氯酸具有漂白性,
故答案为:装置B中的有色布条不褪色,装置C中的有色布条褪色;Cl2+H2O?HCl+HClO;
③实验室用氢氧化钠溶液吸收多余的Cl2,生成氯化钠和次氯酸钠,所以离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
④氯气与石灰乳反应生成氯化钙和次氯酸钙,反应的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,同时生成碳酸钙沉淀,反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
点评 本题考查氯气的制备实验,题目综合性较强,侧重分析能力及实验能力及所学知识分析问题、解决问题的能力的综合考查,注意氯气的漂白性的探究实验原理,题目难度中等.

| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
| E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
(2)E元素原子的核外电子排布式为1s22s22p63s23p63d 64s2;
(3)盐X的水溶液呈酸性(填“酸性”“碱性”或“中性”);
(4)C单质分子中σ键和π键的个数比为1:2,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是NH3分子间存在氢键;
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式:
 ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+. | A. | Na+、K+、SO42-、MnO4- | B. | Ca2+、NH4+、Cl-、NO3- | ||
| C. | Mg2+、K+、HCO3-、Cl- | D. | Na+、K+、SO32-、SO42- |
 变”)
变”)
