题目内容
5.镁、铝、铁是重要的金属,在工业生产中用途广泛.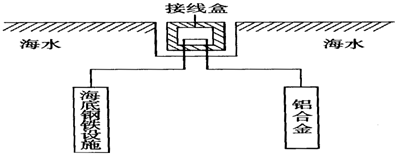
(1)镁与稀硫酸反应的离子方程式为Mg+2H+=Mg2++H2↑;
(2)铝与氧化铁发生铝热反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀.其中正极的电极反应式为2H2O+O2+4e-=4OH-;
(4)在海洋工程上,通常用铝合金(Al-Zn-Cd)保护海底钢铁设施,其原理如图所示.其中负极发生的电极反应为Al-3e-=Al3+;在实际应用中,用铝合金而不选用纯铝.纯铝不能很好地起到保护作用,其原因是铝表面易被氧化,生成一层致密而坚固的氧化物薄膜,阻止金属继续氧化,使金属具有抗腐蚀性能.
分析 (1)Mg与稀硫酸反应生成硫酸镁和氢气;
(2)铝与氧化铁发生铝热反应,生成氧化铝和Fe;
(3)钢铁表面有一层水膜,发生吸氧腐蚀,负极Fe失去电子,正极上氧气得到电子;
(4)保护海底钢铁设施,则海底钢铁应为正极被保护,而铝合金作负极,纯铝易被氧化生成致密的氧化膜.
解答 解:(1)Mg与稀硫酸反应生成硫酸镁和氢气,离子反应为Mg+2H+=Mg2++H2↑,故答案为:Mg+2H+=Mg2++H2↑;
(2)铝与氧化铁发生铝热反应,生成氧化铝和Fe,该反应为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(3)钢铁表面有一层水膜,发生吸氧腐蚀,负极Fe失去电子,正极上氧气得到电子,正极的电极反应式为2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-;
(4)保护海底钢铁设施,则海底钢铁应为正极被保护,而铝合金作负极,负极发生的电极反应为Al-3e-=Al3+,在实际应用中,用铝合金而不选用纯铝.纯铝不能很好地起到保护作用,其原因是铝表面易被氧化,生成一层致密而坚固的氧化物薄膜,阻止金属继续氧化,使金属具有抗腐蚀性能,
故答案为:Al-3e-=Al3+;铝表面易被氧化,生成一层致密而坚固的氧化物薄膜,阻止金属继续氧化,使金属具有抗腐蚀性能.
点评 本题考查金属及化合物的综合应用,为高频考点,把握金属的化学性质、电化学腐蚀及应用等为解答的关键,侧重分析与应用能力的考查,题目难度不大,注意氧化铝为致密的结构.

练习册系列答案
相关题目
15.分子式为C5H10O2的羧酸和酯且有3个甲基的同分异构体共有(不考虑立体异构)( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
16.常温时,下列关于溶液的pH或微粒的物质的量浓度的说法不正确的是( )
| A. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c( R2-)+c( HR- )=c( Na+ ) | |
| B. | 某溶液中只存在Cl-、OH-、NH4+、H+四种离子,则一定不存在下列关系:c( Cl- )>c( NH4+ )>c( H+ )=c( OH- ) | |
| C. | 某物质的溶液中由水电离出的c ( H+ )=1×10-amol•L-1,若a>7,则溶液的pH一定为14-a | |
| D. | 将0.2 mol•L-1的某一元酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液中:2 c( OH- )+c( A- )=2 c( H+ )+c( HA ) |
13.X、Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如表:
(1)W位于元素周期表第四周期第IB族,W的基态原子核外电子排布式为:1s22s22p63s23p63d104s1.
(2)Y的第一电离能比Z的大(填“大”或者“小”),YX3与X2Z的分子中存在的σ键之比为3:2,Y的简单氢化物在水中有惊人的溶解度,解释其原因NH3与H2O分子之间形成氢键.
(3)Y2X4与WZ在加热条件下制得W单质,写出化学方程式并标出电子转移的方向与数目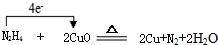 .
.
| 元素 | 相关信息 |
| X | 由X形成的单质是最清洁的能源 |
| Y | Y的基态原子核外P能级电子数比S能级少一个 |
| Z | 由Z形成的多种单质,其中之一是地球的“保护伞” |
| W | W的基态原子核外最外层只有1个电子,是人类社会最早使用的货币金属 |
(2)Y的第一电离能比Z的大(填“大”或者“小”),YX3与X2Z的分子中存在的σ键之比为3:2,Y的简单氢化物在水中有惊人的溶解度,解释其原因NH3与H2O分子之间形成氢键.
(3)Y2X4与WZ在加热条件下制得W单质,写出化学方程式并标出电子转移的方向与数目
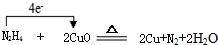 .
.
10.化学与生活、社会、材料密切相关.下列说法不正确的是( )
| A. | 纯碱可用于生产普通玻璃,可用纯碱除去物品表面的油污 | |
| B. | 盐卤点豆腐、明矾净水与胶体的性质有关 | |
| C. | 高温条件下可杀死H7N9型禽流感病毒,属于蛋白质的变性 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子 |
14.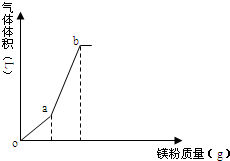 向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
 向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )
向一定量的NH4HSO4溶液中逐渐加入镁粉,所得气体体积随镁粉质量变化如图(忽略温度变化及气体溶解),下列有关说法正确的是( )| A. | o点时,溶液显酸性的主要原因为:NH4++H2O═NH3•H2O+H+ | |
| B. | oa段溶液pH增大,c(NH4+)减小 | |
| C. | b点溶液显中性 | |
| D. | a、b点气体体积比为1:3 |
15.将X mol的Cl2通入到60mL,10.00mol•L-1的浓NaOH溶液中,加热一段时间后,溶液中只有NaCl、NaClO、NaClO3三种溶质,则下列分析合理的是( )
| A. | X=0.6mol | |
| B. | 离子的物质的量关系满足n(Cl-)=5n(ClO-)+n(ClO3-) | |
| C. | 若反应中转移的电子为n mol,则有0.3<n<0.5 | |
| D. | ClO3-的物质的量范围是:0.1mol<n(ClO3-)<0.3mol |
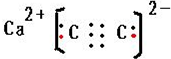 ;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).
;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号). 开发新能源和三废处理都是可持续发展的重要方面.
开发新能源和三废处理都是可持续发展的重要方面.