题目内容
20.元素周期表中ⅣA族元素(C、Si、Ge、Sn、Pb)的单质及其化合物的用途广泛.(1)在ⅣA族元素中,其最高价氧化物对应水化物酸性最强的是H2CO3(填化学式),简单气态氢化物沸点最低的是CH4(填化学式).
(2)金刚砂(SiC)的晶体结构与金刚石、晶体硅类似,它们均为原子晶体,其中熔沸点最低的是晶体硅(填名称).
(3)焦炭可用于制备电石、生产水煤气等,电石的主要成分是CaC2,CaC2的电子式是
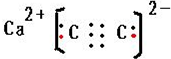 ;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).
;制备电石还需要用到CaCO3.组成CaCO3的三种元素的第一电离能按从大到小的顺序排列为O>C>Ca(填元素符号).(4)甲硅烷(SiH4)是一种无色的液体,遇到空气能发生爆炸性自燃,生成二氧化硅固体和水.在室温下,10g SiH4燃烧放出热量446kJ,请写出其燃烧的热化学方程式:SiH4(l)+2O2(g)=SiO2(s)+2H2O(l)△H=-1427.2kJ•mol-1.
(5)铅是一种金属元素,可用作蓄电池的材料,其合金可作铅字、轴承、电缆包皮之用,还可做体育运动器材铅球等.配平下列化学反应方程式,把系数以及相关物质(写化学式)填写在空格上,并标出电子转移的方向和数目.
5PbO2+2MnSO4+6HNO3=2HMnO4+3Pb(NO3)2+2PbSO4↓+2H2O.
分析 (1)元素非金属性越强最高价氧化物对应水化物酸性越强,所以最强的是碳酸;相对分子量最小氢化物沸点最低;
(2)金刚砂(SiC)的晶体结构与金刚石、晶体硅类似,它们均为原子晶体,共价键的键能越长,熔沸点越低;
(3)CaC2的电子式是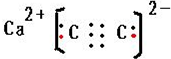 ;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,而钙是金属电离能最小,据此判断第一电离能大小顺序为O>C>Ca;
;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,而钙是金属电离能最小,据此判断第一电离能大小顺序为O>C>Ca;
(4)根据甲硅烷的质量计算1mol甲硅烷燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题;
(5)根据氧化还原反应中化合价升降相等配平,然后利用单线桥表示出该反应中电子转移的方向和数目.
解答 解:(1)元素非金属性越强最高价氧化物对应水化物酸性越强,所以最强的是碳酸;相对分子量最小氢化物沸点最低,所以是甲烷,故答案为:H2CO3;CH4;
(2)金刚砂(SiC)的晶体结构与金刚石、晶体硅类似,它们均为原子晶体,共价键的键能越长,熔沸点越低,硅硅键的键长最长,故答案为:原子;晶体硅;
(3)CaC2的电子式是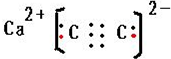 ;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,而钙是金属,据此判断第一电离能大小顺序为O>C>Ca,故答案为:
;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,而钙是金属,据此判断第一电离能大小顺序为O>C>Ca,故答案为: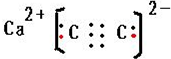 ; O>C>Ca;
; O>C>Ca;
(4)n(SiH4)=$\frac{10g}{32g/mol}$=$\frac{10}{32}$mol,则1molSiH4燃烧放出的热量为:446kJ×$\frac{10}{32}$=1427.2kJ,
反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(l)+2O2(g)=SiO2(s)+2H2O(l)△H=-1427.2 kJ•mol-1,
故答案为:SiH4(l)+2O2(g)=SiO2(s)+2H2O(l)△H=-1427.2 kJ•mol-1;
(5)PbO2中Pb的化合价从+4变为+2价,化合价降低2价;MnSO4中锰元素化合价从+2变为+7,化合价升高5价,则化合价变化的最小公倍数为10,所以二氧化铅的系数为5,硫酸锰的稀释为2,然后利用质量守恒定律可知生成物中未知物为H2O,配平后的反应为:5Pb2+2MnSO4+6HNO3=2HMnO4+3Pb(NO3)2+2PbSO4↓+2H2O,用单线桥表示电子转移的方向和数目为: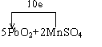 ,
,
故答案为:5; 2; 6; 2; 3; 2; 2H2O; 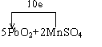 .
.
点评 本题考查了原子结构与元素周期律的关系、氧化还原反应的配平及其综合应用,题目难度中等,试题知识点较多、综合性较强,注意掌握原子结构与电离能之间的关系,明确氧化还原反应配平原则,能够利用单线桥或双线桥法分析电子转移的方向和数目.

| A. | C4H8 | B. | C2H6O | C. | C3H6O | D. | C2H4O2 |
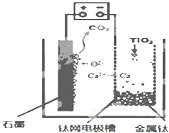 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( )| A. | 由TiO2制得1mol 金属Ti,理论上外电路转移2NA电子 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 | |
| D. | 在制备金属钛前后,整套装置中CaO的总量减少 |
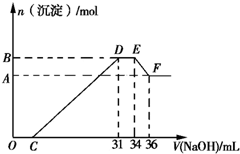 硝酸的还原产物比较复杂,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )
硝酸的还原产物比较复杂,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( )| A. | 反应中硝酸的还原产物为NH4+ | |
| B. | DE段反应的离子方程式为:NH4++OH-═NH3•H2O | |
| C. | 合金中铁和铝的物质的量之比为1:3 | |
| D. | 图象中C点所加NaOH溶液的体积为7mL |
| A. | 某温度下纯水的pH=6,该温度下10L pH=11的NaOH溶液中含OH-的数目为NA | |
| B. | 1mol Cl2与足量的铁反应转移的电子数与1mol铁与足量的Cl2反应转移的电子数相等 | |
| C. | 在标准状况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA | |
| D. | 0.5mol•L-1 Na2SO4溶液中含有的阴、阳离子总数为1.5NA |
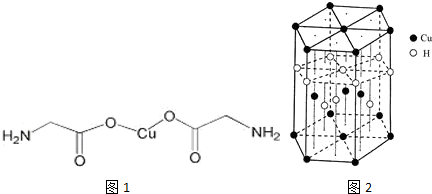
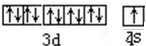 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.
,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有K Cr(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为O<N.
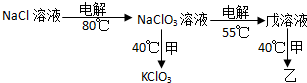
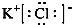 ;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).
;试比较稳定性:KClO3<乙(填“>”、“<”或“=”).