题目内容
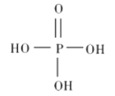
【题目】硫的含氧酸有很多种,除常见的硫酸、亚硫酸外,还有很多其他酸,如焦亚硫酸(H2S2O5)、过一硫酸(H2SO5) 和过二硫酸(H2S2O8) 等。过一硫酸是一种一元强酸,可用于游泳池消毒,其结构式如图所示。过二硫酸是一种白色晶体,受热易分解,有强吸水性,极易溶于水且在水中会逐渐水解得到硫酸和过氧化氢,请回答下列相关问题。
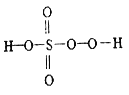
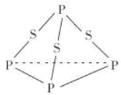
(1)过一硫酸中硫元素的化合价是_________。过二硫酸的结构式是_____________。
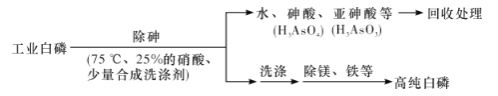
(2)工业上制备过二硫酸溶液的流程之一如下:
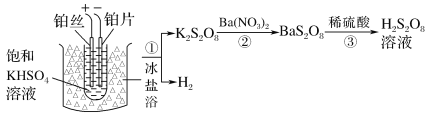
①电解时阳极的电极反应式为______
②阳极材料能否用铜丝代替铂丝?________(填“能”或“不能”),说明理由:__________。
(3)焦亚硫酸钠(Na2S2O5)是重要的抗氧化剂,工业上利用烟道气中的SO2生产Na2S2O5的工艺为:
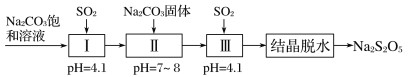
①pH=4.1时,Ⅰ中为________溶液(写化学式)。
②工艺中加入Na2CO3固体,并再次充入SO2的目的是___________。
③葡萄酒常用Na2S2O5作抗氧化剂,在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_______________ ,该样品中Na2S2O5的残留量为______g·L-1(以SO2计)。
【答案】+6  2SO42--2e-===S2O82- 不能 铜是活性电极,铜作阳极时本身会失去电子 NaHSO3 得到NaHSO3过饱和溶液 S2O52-+2I2+3H2O===2SO42-+4I-+6H+ 0.128
2SO42--2e-===S2O82- 不能 铜是活性电极,铜作阳极时本身会失去电子 NaHSO3 得到NaHSO3过饱和溶液 S2O52-+2I2+3H2O===2SO42-+4I-+6H+ 0.128
【解析】
(1)过一硫酸中,H显+1价,5个O中,有3个显-2价,2个显-1价,由此可确定硫元素的化合价。过二硫酸可看作是H2O2中氢原子被-SO3H取代的产物,由此可确定其结构式。
(2)①在电解池中,与电源负极相连的是电解池的阴极,在阴极,H+得电子生成H2,在阳极,SO42-失电子转化为S2O82-,由此可写出电解时阳极的电极反应式。
②阳极材料若用铜丝代替铂丝,则铜失电子,不可能生成S2O82-。
(3)焦亚硫酸钠(Na2S2O5)是由NaHSO3结晶脱水生成,所以前面各项操作的目的是为了获得浓度尽可能大的NaHSO3溶液,两次使用Na2CO3,两次通入SO2,都是为了提高溶液中NaHSO3的浓度。
在测定某葡萄酒中Na2S2O5残留量时,可利用反应建立关系式:S2O52-——2I2——2SO2,利用已知数据求解。
(1)过一硫酸中,硫与氧形成6个共用电子对,硫元素的化合价是+6价。过二硫酸可看作是H2O2中氢原子被-SO3H取代的产物,其结构简式为过二硫酸的结构式是 。答案为:+6;
。答案为:+6; ;
;
(2)①电解产物中的H2一定在阴极生成,则阳极产物为S2O82-,电极反应式为2SO42--2e-== S2O82-。答案为:2SO42--2e-==S2O82-;
②不能用铜丝代替铂丝,阳极用铜丝时,铜失电子,不能生成S2O82-,理由为:铜是活性电极,铜作阳极时本身会失去电子。答案为:不能;铜是活性电极,铜作阳极时本身会失去电子;
(3)①酸性条件下,过量SO2与Na2CO3溶液反应生成NaHSO3。答案为:NaHSO3;
②工艺中加入Na2CO3固体并再次通入SO2,可不断增大溶液中溶质的质量,从而使溶液的浓度不断增大,其目的是得到NaHSO3过饱和溶液。答案为:得到NaHSO3过饱和溶液;
③根据得失电子、电荷及质量守恒,可写出反应的离子方程式为S2O52-+2I2+3H2O==2SO42-+4I-+6H+,n(S2O52-)=![]() ×n(I2)=
×n(I2)=![]() ×0.010 00 mol·L-1×10.00×10-3 L=5×10-5 mol,该样品中S2O52-的残留量(以SO2计)为5×10-5 mol×2×64 g·mol-1×
×0.010 00 mol·L-1×10.00×10-3 L=5×10-5 mol,该样品中S2O52-的残留量(以SO2计)为5×10-5 mol×2×64 g·mol-1×![]() =0.128 g·L-1。答案为:S2O52-+2I2+3H2O==2SO42-+4I-+6H+;0.128。
=0.128 g·L-1。答案为:S2O52-+2I2+3H2O==2SO42-+4I-+6H+;0.128。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。回收处理该废电池可得到多种化工原料。有关数据如下表所示:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)Fe(OH)3沉淀溶解平衡常数(Ksp)的表达式是什么?__________________。
(2)Fe(OH)3能否溶于稀硫酸?________。试用沉淀溶解平衡理论解释。____________。
(3)常温下,若使FeCl3溶液中的Fe3+沉淀完全,需加入NaOH溶液调整溶液的pH为多少?(离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全)_____________。
(4)向等物质的量浓度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先产生的沉淀是什么?_____________。
(5)若在ZnCl2溶液中混有少量的Fe2+,应如何除去?_________。
【题目】苯甲酸乙酯稍有水果气味,用于配制香水香精和人造精油,也大量用于食品中,实验室制备方法如下:

Ⅰ苯甲酸乙酯粗产品的制备
在干燥的50 mL三颈圆底烧瓶中,加入6.1g苯甲酸、过量无水乙醇、8 mL苯和1mL浓硫酸,摇匀后加沸石,安装分水器。水浴加热,开始控制回流速度1~2 d/s。反应时苯一乙醇﹣水会形成“共沸物”蒸馏出来。加热回流约1小时,至分水器中不再有小水珠生成时,停止加热。改为蒸馏装置,蒸出过量乙醇和苯。
沸点(℃) | 相对分子质量 | |
苯甲酸 | 249 | 122 |
苯甲酸乙酯 | 212.6 | 150 |
(1)写出苯甲酸与用18O标记的乙醇酯化反应的方程式___________________。
(2)装置A的名称及冷水通入口_________________________。
(3)通过分水器不断分离除去反应生成的水,目的是___________________。还有什么方法可以实现同样的目的_____________(任答两种)。
(4)实验过程中没有加沸石,请写出补加沸石的操作___________________。
(5)图二装置中的错误______________________。
Ⅱ.苯甲酸乙酯的精制
将苯甲酸乙酯粗产品用如下方法进行精制:将烧瓶中的液体倒入盛有30 mL冷水的烧杯中,搅拌下分批加入饱和Na2CO3溶液(或研细的粉末),至无气体产生,pH试纸检测下层溶液呈中性。用分液漏斗分出粗产物,水层用乙醚(10 mL)萃取。合并有机相,用无水CaCl2干燥。干燥后的粗产物先用水浴蒸除乙醚,再改用减压蒸馏,收集馏分。
(6)加入饱和碳酸钠溶液除了可以降低苯甲酸乙酯溶解度外,还有的作用是__________。
(7)按照纠正后的操作进行,测得产品体积为5mL(苯甲酸乙酯密度为1.05gcm﹣3)。实验的产率为_________。