题目内容
6.中国科技网2013年2月6日报导:中国工程院院士范良士教授领导的研究小组,成功开发出煤清洁燃烧的新方法.该方法的流程如图所示: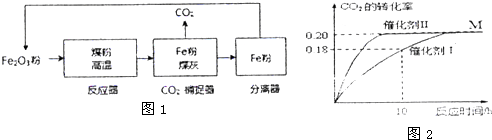
利用化学循环技术使煤释放热量的同时,捕获了反应过程中产生的99%的二氧化碳,高温铁粉用来发电,氧化后循环使用,达到电力和化工的联产,煤炭资源综合利用的目的.
(1)己知下列热化学方程式:
①C(s)+1/2O2(g)=CO(g)△H1=-110.4KJ/mo1
②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=-26.7KJ/mo1
则Fe2O3与C(s)反应生成Fe(s)和CO2(g)的热化学方程式为:2Fe2O3+3C(s)=4Fe(s)+3CO2(g)△H=464.7KJ/mol.
(2)捕捉到的CO2可以和H2合成绿色燃料甲醇.300°C时,在两个容积均为2L的密闭容器中,当c(CO2)=1.00mo1•L-1、c(H2)=1.60mol•L-1时,
分别选择催化剂I、催化剂Ⅱ开始反应,达到平衡状态M.反应结果如图所示.
请回答下列问题:
①使用催化剂I时,反应在10h内的平均反应速率:
V(H2)=0.054mol/•(L•h)-1.达到平衡M时比较两个容器中的正反应速率催化剂I<催化剂II(填“>”或“<”或“=”).
②达到平衡M后,甲醇的体积分数为9.10(保留到小数点后两位);此反应在300°C时的平衡常数为0.05.
③若继续向上述平衡体系M中通入0.4molCO2和0.4mol甲醇,平衡将向逆向移动(填“正向”或“逆向”),达到平衡时得到H2的浓度为amol/L;若继续向上述平衡体系M中通入0.8molCO2和0.4molH2O,达到平衡时得到H2的浓度为bmol/L,则a>b(填“>”或“<”或“=”).
分析 (1)依据热化学方程式和盖斯定律计算,[(①-②×$\frac{1}{2}$)×3+③]×2得到所需热化学方程式;
(2)①根据反应在10小时内二氧化碳的转化率计算出消耗二氧化碳的物质的量浓度,再计算出用二氧化碳表示的平均反应速率,最后根据反应速率与化学计量数的关系计算出用氢气表示的反应速率,催化剂加快反应速率,达到平衡所需时间短;
②分析图象数据结合化学平衡三段式列式计算,体积分数=物质的量的分数=$\frac{甲醇物质的量}{平衡混合气体总物质的量}$×100%,平衡常数等于平衡状态生成物平衡浓度除以反应物平衡浓度;
③计算此时的浓度商和平衡常数比较分析判断平衡移动方向,两种反应物增大一种物质会提高另一种物质的转化率.
解答 解:(1)①C(s)+1/2O2(g)=CO(g)△H1=-110.4KJ/mo1
②C(s)+O2(g)=CO2(g)△H2=-393.5kJ/mol
③Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H3=-26.7KJ/mo1
依据盖斯定律[(①-②×$\frac{1}{2}$)×3+③]×2得到,Fe2O3与C(s)反应生成Fe(s)和CO2(g)的热化学方程式为:2Fe2O3+3C(s)=4Fe(s)+3CO2(g)△H=464.7KJ/mol,
故答案为:2Fe2O3+3C(s)=4Fe(s)+3CO2(g)△H=464.7KJ/mol;
(2)①用催化剂I时,反应在10小时内二氧化碳的转化率为0.18,二氧化碳的浓度变化为:1.00mol•L-1×0.18=0.18mol/L,则反应在10小时内二氧化碳的平均反应速率为:v(CO2)=$\frac{0.18mol/L}{10h}$=0.018mol•(L•h)-1,则v(H2)=3v(CO2)=0.054mol•(L•h)-1,达到平衡M时催化剂I需要的时间长,则两个容器中的正反应速率催化剂I<催化剂Ⅱ,
故答案为:0.054,<;
②反应为CO2(g)+3H2(g)?CH3OH(g)+H2O(g),结合化学平衡三段式列式,平衡时二氧化碳转化率为20%,反应的二氧化碳物质的量=20%×1mol/L×2=0.4mol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 2 3.2 0 0
变化量(mol) 0.4 1.2 0.4 0.4
平衡量(mol) 1.6 2 0.4 0.4
甲醇的体积分数=$\frac{0.4mol}{(1.6+2+0.4+0.4)mol}$×100%=9.10%
平衡常数=$\frac{\frac{0.4}{2}×\frac{0.4}{2}}{\frac{1.6}{2}×(\frac{2}{2})^{3}}$=0.05
故答案为:9.10%,0.05;
③若继续向上述平衡体系M中通入0.4molCO2和0.4mol甲醇,此时浓度商=$\frac{\frac{0.4}{2}×\frac{0.4+0.4}{2}}{\frac{1.6+0.4}{2}×(\frac{2}{2})^{3}}$=0.08>K=0.05,平衡逆向进行,若继续向上述平衡体系M中通入0.8molCO2和0.4molH2O,两种反应物增大一种物质会提高另一种物质的转化率,氢气浓度减小,达到平衡时得到H2的浓度amol/>bmol/L,
故答案为:逆向,>.
点评 本题考查了热化学方程式书写和盖斯定律的计算应用,化学平衡的计算应用,平衡常数的计算应用是解题关键,题目难度中等.

| A. | 1:1:1 | B. | 2:1:1 | C. | 1:2:1 | D. | 1:1:3 |
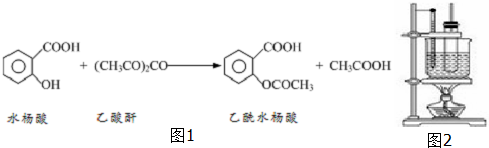
【反应原理】
如图1
【物质性质】
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 乙酸酐 | 139 | 在水中逐渐分解 | 略 |
| 乙酰水杨酸 | 略 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | 略 |
| 乙酸 | 117.9 | 略 | 略 |
(1)物质制备:向大试管中依次加入2g水杨酸、5mL乙酸酐(密度为1.08g/mL)、5滴浓硫酸,振荡大试管至水杨酸全部溶解,将其放入盛有热水烧杯中,固定在铁架台上,在85℃~90℃条件下加热5~10min.装置如图2:
(2)产品结晶:取下大试管,置于冷水中冷却10min.待晶体完全析出,…抽滤,再洗涤晶体,抽干.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂NaHCO3并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸1.8g.
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色.
【问题讨论】
(1)写出水杨酸与碳酸氢钠溶液反应的化学反应方程式
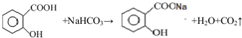 .
.(2)写出水杨酸与足量碳酸钠溶液反应后含苯环的生成物的结构简式
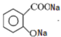 .
.(3)流程(1)装置图中长导管的作用冷凝回流和平衡压强.
(4)控制反应温度85℃~90℃的原因既保持有较高的反应速率又减少物质的挥发.
(5)流程(2)中证明晶体洗涤干净的操作方法:取最后一次洗涤滤液少许于试管中,滴加少量氯化钡,再滴加稀盐酸,若无沉淀出现则洗涤干净,反之则未洗涤干净
(6)流程(4)中溶液显紫色,可能的原因是产品中仍然可能有水杨酸.
(7)1mol乙酰水杨酸与氢氧化钠溶液反应可能,最多消耗3mol NaOH.
(8)实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
| A. | 0.4molH2O | B. | 0.2mol H2SO4 | C. | 0.8molHCl | D. | 0.3molHNO3 |
| A. | 1L lmol•L-1 FeBr2溶液与lmol氯气反应时转移的电子数为3NA | |
| B. | 0.5 mol•L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| C. | 1mol硫酸氢钠固体中含阳离子总数NA | |
| D. | 28g由乙烯和聚乙烯组成的混合气体中含有碳碳双键数为NA |
| A. | 稀硫酸中加入铜粉:Cu+2H+═Cu2++H2↑ | |
| B. | 用FeCl3溶液刻蚀铜制印刷电路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO32-+H2O | |
| D. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
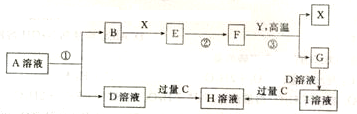
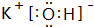 ,H的化学式为KHCO3;
,H的化学式为KHCO3;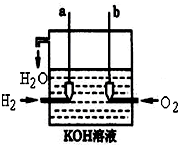 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.