题目内容
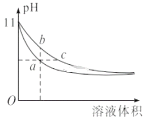
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列说法正确的是
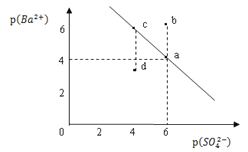
A. 该温度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
【答案】B
【解析】
根据已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)可以得出沉淀溶解平衡线随着横坐标增大,硫酸根离子浓度逐渐减小,钡离子浓度增大;a、c达到了沉淀溶解平衡,d属于过饱和溶液,b属于未饱和溶液。
A.a点钡离子浓度和硫酸根离子浓度分别为1.0×10-4和1.0×10-6,所以Ksp(BaSO4)=1.0×10-10,故A错误;
B. c加入BaCl2可以使溶液钡离子浓度增大,硫酸根离子浓度减小,由c点变到a点,故B正确;
C.p(Ba2+)的值越大,钡离子浓度越小,所以d点是过饱和溶液,故C错误;
D.图中的是平衡曲线,线上的任意点都是平衡状态,所以a、b点Ksp相同,a点的Ksp(BaSO4)等于b点的Ksp(BaSO4),故D错误;

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目