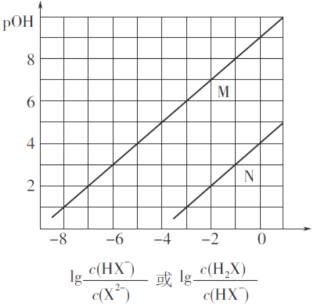
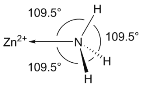
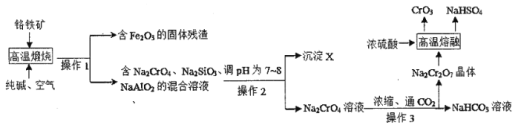
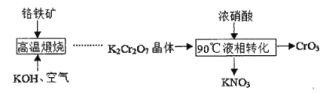
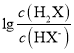题目内容
【题目】向Cu和CuO的混合物中加入0.6 L2.0 mol/L的稀硝酸,混合物完全溶解,同时生成标准状况下NO 4.48 L。向所得溶液中加入一定体积1.0 mol/L NaOH溶液,恰好使Cu2+完全沉淀,将沉淀洗涤,充分灼烧后得32.0 g固体。求:
(1)混合物中Cu的质量是____________。
(2)混合物消耗HNO3的物质的量是____________。
(3)NaOH溶液的体积是____________。
(4)Cu2+完全反应后,溶液中NO3-的物质的量浓度是____________。
【答案】19.2 g 1 mol 1000 mL 0.625 mol/L
【解析】
(1)计算出标况下4.48LNO的物质的量,根据电子守恒计算出混合物中铜的物质的量,再根据m=nM计算出铜的质量;
(2)最终得到的固体为氧化铜,根据n=![]() 计算出氧化铜的物质的量;反应消耗的硝酸为生成硝酸铜和生成NO所消耗的,根据N原子守恒计算出消耗硝酸的物质的量;
计算出氧化铜的物质的量;反应消耗的硝酸为生成硝酸铜和生成NO所消耗的,根据N原子守恒计算出消耗硝酸的物质的量;
(3)铜离子完全沉淀时,溶质为硝酸钠,根据溶液中硝酸根离子的物质的量计算出氢氧化钠的物质的量;
(4)根据c=![]() 计算氢氧化钠的浓度、硝酸根离子浓度,据此进行计算。
计算氢氧化钠的浓度、硝酸根离子浓度,据此进行计算。
(1)标况下4.48LNO的物质的量为:![]() =0.2mol,根据电子守恒,原混合物中含有铜的物质的量为:n(Cu)=
=0.2mol,根据电子守恒,原混合物中含有铜的物质的量为:n(Cu)=![]() =0.3mol,其质量为:64g/mol×0.3mol=19.2g;
=0.3mol,其质量为:64g/mol×0.3mol=19.2g;
(2)最终得到的32.0g为氧化铜,氧化铜的物质的量为:![]() =0.4mol,根据铜原子守恒可知,原混合物中含有CuO的物质的量为:0.4mol0.3mol=0.1mol,与该混合物反应的硝酸反应后生成硝酸铜和NO,根据氮原子守恒,消耗硝酸的物质的量为:0.4mol×2+0.2mol=1mol;
=0.4mol,根据铜原子守恒可知,原混合物中含有CuO的物质的量为:0.4mol0.3mol=0.1mol,与该混合物反应的硝酸反应后生成硝酸铜和NO,根据氮原子守恒,消耗硝酸的物质的量为:0.4mol×2+0.2mol=1mol;
(3)0.6L2.0mol/L稀硝酸中含有硝酸的物质的量为:2.0mol/L×0.6L=1.2mol,向所得溶液中加入一定体积1.0mol/LNaOH溶液,恰好使Cu2+沉淀完全,此时溶质为硝酸钠,反应后溶液中硝酸根离子的物质的量为:1.2mol0.2mol=1.0mol,根据钠原子守恒,消耗氢氧化钠的物质的量为1.0mol,消耗氢氧化钠溶液的体积为:![]() =1L=1000mL;
=1L=1000mL;
(4)铜离子完全沉淀时,根据(3)可知,硝酸根离子的物质的量为1mol,浓度为:![]() =0.625mol/L。
=0.625mol/L。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案