题目内容
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),结合下图回答问题。
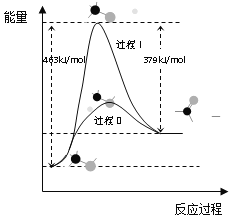
①此反应的热化学方程式是______
②反应活化能:过程I___过程II(填“>”“=”或“<”)
③过程II温度—转化率图如下,下列说法合理的是_____
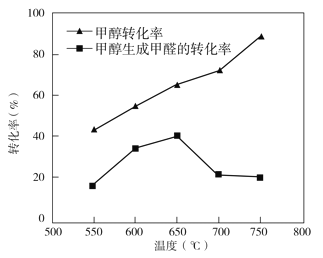
a.甲醇脱氢法制备甲醛过程无副反应发生
b.温度高于 650℃催化剂烧结,活性减弱
c.及时分离产品有利于提高甲醇生成甲醛的转化率
(2)甲醛超标会危害人体健康,需对甲醛进行含量检测及污染处理。
①某甲醛气体传感器的工作原理如图所示,b极的电极反应式为____,当电路中转移4×10-4 mol电子时,传感器内参加反应的甲醛(HCHO)为_____mg。

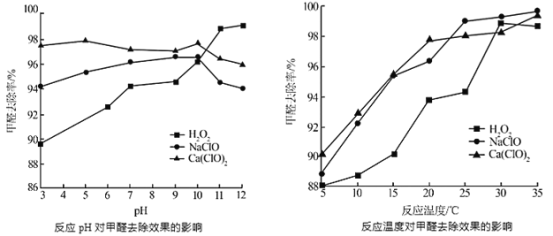
②氧化剂可处理甲醛污染,结合以下图像分析春季(水温约15℃)应急处理甲醛污染的水源应选择的试剂为______
【答案】CH3OH(g)=HCHO(g)+H2(g)⊿H=+84kJ/mol > b、c HCHO-4e-+ H2O= CO2+ 4H+ 3 Ca(ClO)2
【解析】
(1)①由图可知1molCH3OH脱氢生成1molHCHO和1molH2要吸收能量463kJ/mol-379kJ/mol=84kJ/mol,据此写出热化学方程式;
②由图可知反应活化能:过程I>过程II;
③a.由图可知,甲醇转化率大于甲醇生成甲醛的转化率,说明有其它副反应发生;
b.由图可知,温度高于 650℃甲醇生成甲醛的转化率降低,说明催化剂烧结,活性减弱;
c.减小生成物浓度平衡向正反应方向移动,所以及时分离产品有利于提高甲醇生成甲醛的转化率;
(2)①由图可知,甲醛气体传感器为原电池原理,b极为负极,甲醛发生氧化反应生成CO2,以此书写电极反应式;根据电极反应式计算反应的甲醛的量。
②分析图像可知,水温约15℃时选择Ca(ClO)2处理甲醛污染的水源,甲醛去除率较高。
(1)①由图可知1molCH3OH脱氢生成1molHCHO和1molH2要吸收能量463kJ/mol-379kJ/mol=84kJ/mol,所以反应的热化学方程式是CH3OH(g)=HCHO(g)+H2(g)⊿H=+84kJ/mol,
故答案为:CH3OH(g)=HCHO(g)+H2(g)⊿H=+84kJ/mol;
②由图可知反应活化能:过程I>过程II,
故答案为:>;
③a.由图可知,甲醇转化率大于甲醇生成甲醛的转化率,说明有其它反应发生,所以甲醇脱氢法制备甲醛过程有副反应发生,故a错误;
b.由图可知,温度高于 650℃甲醇生成甲醛的转化率降低,说明催化剂烧结,活性减弱,故b正确;
c.减小生成物浓度平衡向正反应方向移动,所以及时分离产品有利于提高甲醇生成甲醛的转化率,故c正确。
故答案为:b、c;
(2)①由图可知,甲醛气体传感器为原电池原理,b极为负极,甲醛发生氧化反应生成CO2,电极反应式为HCHO-4e-+ H2O= CO2+ 4H+;由反应式可知,当电路中转移4×10-4 mol电子时,传感器内参加反应的甲醛(HCHO)为![]() 30g/mol=3
30g/mol=3![]() 10-3g=3mg。
10-3g=3mg。
②分析图像可知,水温约15℃时选择Ca(ClO)2处理甲醛污染的水源,甲醛去除率较高,且甲醛去除率受pH的影响不大;
故答案为:3;Ca(ClO)2。

【题目】现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
金属离子 | Fe3+ | Fe2+ | Cu2+ |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?________________________________,该反应的离子方程式为_________________________________。
(2)溶液II中除Cu2+外,还有______金属离子,检验试剂为______________。物质Y不能为下列的________________________。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
(3)常温下,除去CuCl2溶液中的Fe2+,加入氧化剂X,使Fe2+氧化为Fe3+,然后加入物质Y至溶液pH=4,此时c(Fe3+)=_________mol/L,[已知Fe(OH)3的Ksp=4×10-38]
(4)若在空气中加热固体CuCl2·2H2O,可水解生成Cu(OH)Cl,写出相关的化学方程式_______________________________________。