题目内容
【题目】下列有关说法正确的是
A. 由MgCl2溶液制备无水MgCl2,将MgCl2溶液加热蒸干
B. 室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3·H2O+H3O+
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
【答案】C
【解析】
A.蒸干氯化镁溶液,镁离子会发生水解,MgCl2+2H2O![]() Mg(OH)2+2HCl,因为盐类水解是吸热反应,HCl又易挥发,在蒸发过程中反应一直正向进行,不能得到无水氯化镁,故A错误;
Mg(OH)2+2HCl,因为盐类水解是吸热反应,HCl又易挥发,在蒸发过程中反应一直正向进行,不能得到无水氯化镁,故A错误;
B.室温下测得氯化铵溶液pH<7,溶液中存在水解平衡:NH4++2H2O![]() NH3·H2O+H3O+,可证明一水合氨是弱碱,离子方程式用可逆号,不是等号,故B错误;
NH3·H2O+H3O+,可证明一水合氨是弱碱,离子方程式用可逆号,不是等号,故B错误;
C.盐酸可抑制氯化铁的水解,将氯化铁溶解在较浓的盐酸中再加水稀释可配制氯化铁溶液,故C正确;
D.AlCl3溶液加热、蒸发、浓缩、结晶、灼烧得到氧化铝,而Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体是硫酸铝,所得到的固体成分不同,故D错误;
正确答案:C。

练习册系列答案
相关题目
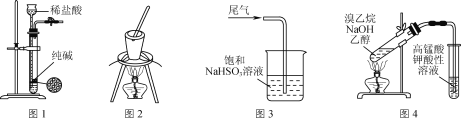
【题目】研究铜和铁与浓硫酸的反应,实验如下:
① | ② |
| |
铜丝表面无明显现象 铁丝表面迅速变黑,之后无明显现象 | 铜丝或铁丝逐渐溶解,产生大量气体, 品红溶液褪色 |
下列说法正确的是
A. 常温下不能用铁制容器盛放浓硫酸,可用铜制容器盛放浓硫酸
B. ②中铜丝或铁丝均有剩余时,产生气体的物质的量相等
C. 依据②,可推断出铜和铁与浓硫酸反应可生成SO2
D. ①②中现象的差异仅是由于温度改变了化学反应速率