题目内容
13. M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )| A. | X元素最高价氧化物对应水化物的酸性弱于Y元素的 | |
| B. | Y元素气态氢化物的稳定性大于Z元素的 | |
| C. | 元素Z在周期表中的位置为第2周期、VIA族 | |
| D. | M元素的氧化物既可以与强酸溶液反应,也可以与强碱溶液反应 |
分析 根据元素周期表中短周期部分的结构和元素位置可知:金属M为Al,X为Si,Y为N,Z为O,
A.非金属性越强,最高价氧化物对应水化物的酸性越强;
B.非金属性越强,气态氢化物的稳定性越强;
C.O原子含有2个电子层,最外层含有6个电子;
D.M为Al元素,其氧化物为氧化铝,氧化铝为两性氧化物.
解答 解:根据元素周期表中短周期部分的结构和元素位置可知:金属M为Al,X为Si,Y为N,Z为O,
A.X为Si、Y为N元素,由于非金属性:N>Si,所以最高价氧化物对应水化物的酸性:HNO3>H2SiO3,故A正确;
B.Y为N元素、Z为O元素,由于非金属性:O>N,所以气态氢化物的稳定性:H2O>NH3,即:Y的气态氢化物的稳定性小于Z的,故B错误;
C.Z为O元素,O原子含有2个电子层,最外层含有6个电子,因此O位于元素周期表中第二周期、第ⅥA族,故C正确;
D.M为Al元素,其氧化物为氧化铝,氧化铝为两性氧化物,既可以与强酸溶液反应,也可以与强碱溶液反应,故D正确;
关系B.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,通过元素周期表中短周期部分的结构和元素位置推出元素种类,熟悉物质的性质和元素周期律的知识是解题的关键,侧重对学生分析能力的培养和解题方法的指导,有助于培养学生规范、严谨的科学素养和评价能力.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
3.如图为元素周期表中前四周期的一部分,下列判断正确的是( )


| A. | 气态氢化物的还原性:X>Y、M>R | B. | 原子半径:Z>M>R、M<X<Y | ||
| C. | M与Z的原子核外电子数相差16 | D. | Q的最高价氧化物一定能溶于强碱 |
4.下列说法不正确的是( )
| A. | 晶体硅可用作制造太阳能电池和光导纤维 | |
| B. | 用饱和氯化铵溶液可以清洗金属表面的锈迹 | |
| C. | “地沟油”禁止食用,但可用来制生物柴油和肥皂 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
8.常温下,下列电解质溶液的有关叙述,错误的是( )
| A. | NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大 | |
| B. | 在NaHCO3溶液中:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等 | |
| D. | 0.1 mol/L 的NaOH溶液和CH3COOH溶液等体积混合,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
5.化学与环境?材料?信息?能源关系密切,下列说法不正确的是( )
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 聚乙炔用I2或Na等做掺杂处理后可形成一种导电塑料,该导电塑料是一种纯净物,有固定的熔点?沸点 | |
| C. | 先通入氯气,再加入硫酸亚铁处理水,能达到消毒杀菌和除去悬浮杂质的目的 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是硅 |
2.从化学角度分析,下列叙述不正确的是( )
| A. | 银氨溶液或新制Cu(OH)2均能检验糖尿病人尿液中的葡萄糖 | |
| B. | 在燃煤中加入适量生石灰,可以减少二氧化硫的排放 | |
| C. | 铜制品在潮湿环境中的腐蚀比干燥环境中快 | |
| D. | 生活中的水杯、奶瓶、食物保鲜膜等可以使用聚氯乙烯来制造 |
3. 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )| A. | 该反应的逆反应△H>0 | |
| B. | 增大反应物中CH3OCOOCH3的浓度能提高碳酸甲乙酯的平衡转化率 | |
| C. | 650℃,反应物配比为1:1时,平衡常数K=6 | |
| D. | 当C2H5OCOOC2H5与CH3OCOOC2H5生成速率比为1:2时,反应达到平衡状态 |
 .合成M的一种途径如下:
.合成M的一种途径如下: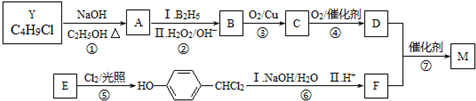
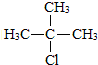 .
. .
.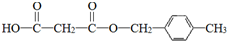 .
.