题目内容
1.在甲溶液中通入过量CO2生成乙和另一种具有漂白性的物质,在乙溶液中滴加某钠盐溶液丙可以生成丁溶液(丁溶液呈中性),同时产生无色无味气体.已知:题中所涉及物质皆为中学化学中常见物质.回答下列问题:(1)甲的化学式为NaClO;
(2)写出乙在医疗上的一个用途治疗胃酸过多;
(3)在乙溶液中滴加丙溶液生成丁溶液的离子方程式为HCO3-+H+=H2O+CO2↑.
分析 在甲溶液中通入过量CO2生成乙和另一种具有漂白性的物质,可知漂白性的物质为HClO,甲溶液为次氯酸盐,乙为碳酸氢盐,在乙溶液中滴加某钠盐溶液丙可以生成丁溶液(丁溶液呈中性),同时产生无色无味气体判断为二氧化碳,说明钠盐丙能和碳酸氢根离子发生反应生成二氧化碳,丁溶液呈中性推断丙为NaHSO4,所以甲为NaClO,据此回答问题.
解答 解:在甲溶液中通入过量CO2生成乙和另一种具有漂白性的物质,可知漂白性的物质为HClO,甲溶液为次氯酸盐,乙为碳酸氢盐,在乙溶液中滴加某钠盐溶液丙可以生成丁溶液(丁溶液呈中性),同时产生无色无味气体判断为二氧化碳,说明钠盐丙能和碳酸氢根离子发生反应生成二氧化碳,丁溶液呈中性推断丙为NaHSO4,元素守恒可知甲为NaClO;
(1)上述分析判断甲为NaClO,故答案为:NaClO;
(2)乙为NaHCO3俗称为小苏打,在医疗上的一个用途可用来治疗胃酸过多,
故答案为:治疗胃酸过多;
(3)在乙溶液中滴加丙溶液生成丁溶液是碳酸氢根离子和氢离子反应生成二氧化碳和水的过程,反应的离子方程式为:HCO3-+H+=H2O+CO2↑,
故答案为:HCO3-+H+=H2O+CO2↑.
点评 本题考查了物质性质的分析判断,反应现象的理解和过程分析应用,主要是漂白性物质的制备,注意过量二氧化碳发生的反应产物分析,掌握物质性质和化学基础是解题关键,题目难度中等.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
11.下列说法正确的是( )
| A. | 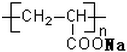 表示一种吸水性高分子树脂 表示一种吸水性高分子树脂 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 | |
| C. | 化合物 是苯的同系物 是苯的同系物 | |
| D. | 异丁烷的八氯代物共有4种(不考虑立体异构) |
12.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,用化学沉降法处理含砷废水,相关数据如下表.
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=0.2mol•L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=c3(Ca2+)•c2(AsO43-),若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)的最大是7.2×10-17mol•L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
| 表1.几种砷酸盐的Ksp | |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-9 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 7.2×10-21 |
| 表2.工厂污染物排放浓度及允许排放标准 | ||
| 污染物 | H2SO4 | As |
| 浓度 | 19.6g/L | 1.6g•L-1 |
| 排放标准 | pH6~9 | 0.5mg•L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=0.2mol•L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=c3(Ca2+)•c2(AsO43-),若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)的最大是7.2×10-17mol•L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
16.反应H2+C12=2HCl(△H<0)的机理包含:①C12→2C1(慢)②H2+Cl→HCl+H (快)③C12+H→HCl+Cl(快)等.下列说法不正确的是( )
| A. | 断开lmol H-H键需要的能量大于断开1mol Cl-Cl键需要的能量 | |
| B. | 反应H2+C12=2HCl在光照和加热条件下的△H不同 | |
| C. | 反应①的活化能大于反应②的活化能 | |
| D. | 已知反应②的△H>O,则反应③的△H一定小于0 |
6.下列有关描述,正确的是( )
| A. | 苯能使溴水褪色,发生取代反应 | |
| B. | 乙烯使高锰酸钾溶液褪色,发生加成反应 | |
| C. | 乙醇在红热铜丝的作用下,能发生氧化反应 | |
| D. | 葡萄糖在稀硫酸作催化剂,水浴加热条件下可以发生水解反应 |
13. M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
 M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )| A. | X元素最高价氧化物对应水化物的酸性弱于Y元素的 | |
| B. | Y元素气态氢化物的稳定性大于Z元素的 | |
| C. | 元素Z在周期表中的位置为第2周期、VIA族 | |
| D. | M元素的氧化物既可以与强酸溶液反应,也可以与强碱溶液反应 |
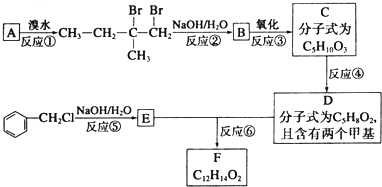
 .
. .
.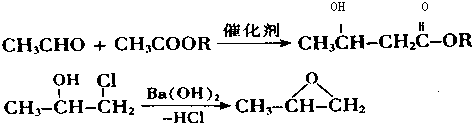
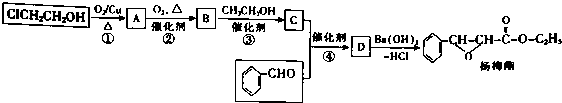
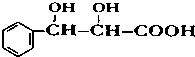 . 下列有关该物质的叙述中,正确的是CD.
. 下列有关该物质的叙述中,正确的是CD.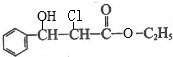 .
. 等.
等. .
.