题目内容
3.如图为元素周期表中前四周期的一部分,下列判断正确的是( )
| A. | 气态氢化物的还原性:X>Y、M>R | B. | 原子半径:Z>M>R、M<X<Y | ||
| C. | M与Z的原子核外电子数相差16 | D. | Q的最高价氧化物一定能溶于强碱 |
分析 A、非金属性越弱氢化物还原性越强;
B、电子层数越多半径越大,电子层相同时核电荷数越多半径越小;
C、同主族元素,第三周期和第四周期相差18;
D、Q可以是Al、硅或P,最高价氧化物能溶于强碱.
解答 解:A、非金属性X<Y、M<R,所以氢化物的还原性为X>Y、M>R,故A正确;
B、同主族从上往下电子层数增多,半径增大,所以原子半径:Z>M>R,同周期从左到右半径减小,所以原子半径为M>X>Y,故B错误;
C、同主族元素,第三周期和第四周期相差18,故C错误;
D、Q可以是Al、硅或P,最高价氧化物能溶于强碱,故D正确;
故选AD.
点评 本题考查结构位置性质关系、元素周期表的结构、元素周期律等,难度不大,注意掌握元素周期律.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
13.已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10现向1L0.2Lmol.L-1HF溶液中加入1L0.2Lmol.L-1CaCl2溶液,则下列说法中正确的是( )
| A. | 25℃时,0.1mol•L-1HF溶液中pH=1 | |
| B. | Ksp(CaF2)随温度和浓度的变化而变化 | |
| C. | 该体系中没有沉淀产生 | |
| D. | 该体系中有CaF2产生沉淀 |
14.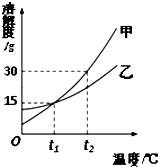 甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
 甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种固体的溶解度曲线如图所示,下列说法正确的是( )| A. | 甲的溶解度大于乙的溶解度 | |
| B. | 将甲的饱和溶液变为不饱和溶液可采用降温的方法 | |
| C. | t1℃时,甲、乙的饱和溶液中溶质的质量分数不一定相等 | |
| D. | t2℃时,将甲、乙等质量的饱和溶液降温至t1℃,甲析出的固体一定大于乙 |
11.下列说法正确的是( )
| A. | 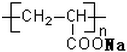 表示一种吸水性高分子树脂 表示一种吸水性高分子树脂 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 | |
| C. | 化合物 是苯的同系物 是苯的同系物 | |
| D. | 异丁烷的八氯代物共有4种(不考虑立体异构) |
8.甲苯的苯环上有5个氢原子,若其中两个氢原子分别被羟基(-OH)和氯原子(-Cl)取代,则可形成的有机物同分异构有( )
| A. | 9种 | B. | 10种 | C. | 12种 | D. | 15种 |
15.下列实验设计不合理的是( )
| A. | 比较相同条件下水解能力:室温下用pH计分别测量同浓度的Na2CO3和NaHCO3溶液的pH | |
| B. | 检验乙烯:无水乙醇和浓硫酸共热到170℃,将制得的气体通入酸性高锰酸钾溶液,观察到溶液紫色很快褪去,证明反应生成了乙烯 | |
| C. | 检验铝热剂中铁的价态:将铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,证明该铝热剂不含氧化铁 | |
| D. | 在2mL同浓度的NaCl、NaI混合溶液中滴入几滴稀AgNO3溶液,观察到产生黄色沉淀,证明Ksp(AgCl)>Ksp(AgI) |
12.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,用化学沉降法处理含砷废水,相关数据如下表.
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=0.2mol•L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=c3(Ca2+)•c2(AsO43-),若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)的最大是7.2×10-17mol•L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
| 表1.几种砷酸盐的Ksp | |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-9 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 7.2×10-21 |
| 表2.工厂污染物排放浓度及允许排放标准 | ||
| 污染物 | H2SO4 | As |
| 浓度 | 19.6g/L | 1.6g•L-1 |
| 排放标准 | pH6~9 | 0.5mg•L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=0.2mol•L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=c3(Ca2+)•c2(AsO43-),若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)的最大是7.2×10-17mol•L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
13. M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
 M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )| A. | X元素最高价氧化物对应水化物的酸性弱于Y元素的 | |
| B. | Y元素气态氢化物的稳定性大于Z元素的 | |
| C. | 元素Z在周期表中的位置为第2周期、VIA族 | |
| D. | M元素的氧化物既可以与强酸溶液反应,也可以与强碱溶液反应 |