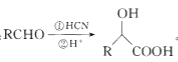
题目内容
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义.
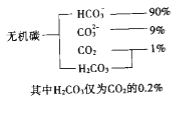
(1)海水中无机碳的存在形式及分布如下图所示:
用离子方程式表示海水呈弱碱性的原因______________.已知春季海水pH=8.1,预测夏季海水碱性将会_____________(填写“增强”或“减弱”),理由是_________________________.
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) △H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇.如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.下列说法正确的是_______________.
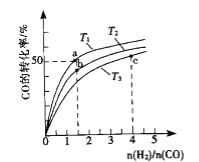
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点状态下再通入0.5 mol co和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 mol co和4mol H2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
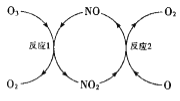
①NO的作用是___________________。
②已知:O3(g)+0(g)=202(g) △H=-143kJ·mol-l
反应1: O3(g)+NO(g)NO2(g)+O2(g) △H1=-200.2kJ·mol-l
反应2:热化学方程式为_____________________。
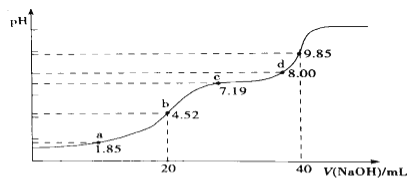
(4)大气污染物SO2可用NaOH吸收.已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol· L-1 NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如图所示.b点所得溶液中各离子浓度由大到小的顺序是________________;c点所得溶液中:c(Na+)___________3c(HSO3-)(填“>”、“<”或“=”).
【答案】HCO3-+H2O![]() H2CO3+OH-或CO32-+H2O
H2CO3+OH-或CO32-+H2O![]() HCO3-+OH- 增强 一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O
HCO3-+OH- 增强 一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O![]() H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱 C 催化剂 NO2(g)+O(g)═NO(g)+O2(g)△H2=+57.2kJ/mol c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-) >
H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱 C 催化剂 NO2(g)+O(g)═NO(g)+O2(g)△H2=+57.2kJ/mol c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-) >
【解析】
(1)本小题考查是盐类水解,强碱弱酸盐水解显碱性,强酸弱碱盐显酸性;水解平衡为吸热反应,夏天温度升高,水解平衡正向移动,溶液碱性增强;
(2)A.图中![]() 值:c>b,该值越大,即增大氢气浓度,正向进行程度越大,CO转化率增大,而氢气转化率减小,图中CO转化率:c>b,则H2转化率:b>c,a、b两点
值:c>b,该值越大,即增大氢气浓度,正向进行程度越大,CO转化率增大,而氢气转化率减小,图中CO转化率:c>b,则H2转化率:b>c,a、b两点![]() 相同,CO转化率越大,氢气转化率也越大,故氢气转化率:a>b;
相同,CO转化率越大,氢气转化率也越大,故氢气转化率:a>b;
B.图中![]() 一定时,CO的转化率:T1>T2>T3,正反应为放热反应,
一定时,CO的转化率:T1>T2>T3,正反应为放热反应,![]() 一定时,升高温度平衡逆向移动,CO的转化率会减小,故温度:T1<T2<T3;
一定时,升高温度平衡逆向移动,CO的转化率会减小,故温度:T1<T2<T3;
C.利用三段式求出T1温度下平衡常数K,在通入0.5 mol co和0.5 mol CH3OH 后求出Qc,比较K和Qc;
(3)①反应过程如图1是臭氧在NO作用下生成二氧化氮和氧气,二氧化氮在氧原子作用下生成NO和氧气;
②Ⅰ.O3(g)+O(g)═2O2(g)△H=-143kJ/mol
Ⅱ.O3(g)+NO(g)═NO2(g)+O2(g)△H1=-200.2kJ/mol
盖斯定律计算Ⅰ-Ⅱ得到反应2的热化学方程式;
(4)b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性;c点pH=7.19=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2OHSO3-+OH-,Kh=![]() ,c(OH-)=
,c(OH-)=![]() ,带入计算得到:c(HSO32-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3-)。
,带入计算得到:c(HSO32-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3-)。
(1)海水中无机碳的存在形式主要是HCO3-、CO32-,两种离子为弱酸根离子,水解使海水显碱性,离子方程式为HCO3-+H2O![]() H2CO3+OH-或CO32-+H2O
H2CO3+OH-或CO32-+H2O![]() HCO3-+OH-;一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O
HCO3-+OH-;一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O![]() H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱。本小题答案为:HCO3-+H2O
H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱。本小题答案为:HCO3-+H2O![]() H2CO3+OH-或CO32-+H2O
H2CO3+OH-或CO32-+H2O![]() HCO3-+OH-;增强;一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O
HCO3-+OH-;增强;一方面水解平衡为吸热反应,夏天温度升高,平衡正向移动,c(OH-)增大,一方面夏天光合作用强,使得CO2+H2O![]() H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱。
H2CO3平衡逆向移动,酸性减弱,一方面夏天温度高,二氧化碳在水中的溶解度减小,酸性减弱。
(2)A.图中![]() 值:c>b,该值越大,即增大氢气浓度,正向进行程度越大,CO转化率增大,而氢气转化率减小,图中CO转化率:c>b,则H2转化率:b>c,a、b两点
值:c>b,该值越大,即增大氢气浓度,正向进行程度越大,CO转化率增大,而氢气转化率减小,图中CO转化率:c>b,则H2转化率:b>c,a、b两点![]() 相同,CO转化率越大,氢气转化率也越大,故氢气转化率:a>b,可知H2转化率:a>b>c,故A错误;
相同,CO转化率越大,氢气转化率也越大,故氢气转化率:a>b,可知H2转化率:a>b>c,故A错误;
B.图中![]() 一定时,CO的转化率:T1>T2>T3,正反应为放热反应,
一定时,CO的转化率:T1>T2>T3,正反应为放热反应,![]() 一定时,升高温度平衡逆向移动,CO的转化率会减小,故温度:T1<T2<T3,故B错误;
一定时,升高温度平衡逆向移动,CO的转化率会减小,故温度:T1<T2<T3,故B错误;
C.T1温度下,a点![]() =1.5,起始时CO为1mol,则氢气为1.5mol,平衡时CO转化率为50%,反应的CO为0.5mol,容器体积为1L,则:
=1.5,起始时CO为1mol,则氢气为1.5mol,平衡时CO转化率为50%,反应的CO为0.5mol,容器体积为1L,则:
CO(g) + 2H2(g) CH3OH(g)
起始浓度(mol/L): 1 1.5 0
变化浓度(mol/L): 0.5 1 0.5
平衡浓度(mol/L):
故T1温度下平衡常数K=![]() ,而Qc=
,而Qc=![]() ,所以平衡不移动,故C正确;
,所以平衡不移动,故C正确;
D.c点状态下再通入1 molCO和4 molH2,等效为在原平衡的基础上压强增大一倍,正反应为气体体积减小的反应,故平衡正向移动,新平衡中H2的体积分数减小,故D错误。答案选C。
(3)①反应过程是臭氧在NO作用下生成二氧化氮和氧气,二氧化氮在氧原子作用下生成NO和氧气,反应过程中NO参与反应最后又生成,作用是催化剂。本小题答案为:催化剂。
②Ⅰ.O3(g)+O(g)═2O2(g)△H=143kJ/mol
Ⅱ.O3(g)+NO(g)═NO2(g)+O2(g)△H1=200.2kJ/mol
盖斯定律计算ⅠⅡ得到反应2的热化学方程式:NO2(g)+O(g)═NO(g)+O2(g)△H2=+57.2kJ/mol。本小题答案为:NO2(g)+O(g)═NO(g)+O2(g)△H2=+57.2kJ/mol。
(4)b点是用0.1molL-1NaOH溶液20ml滴定20mL0.1molL-1H2SO3溶液,恰好反应生成NaHSO3,溶液显酸性,则溶液中各离子浓度由大到小的顺序是c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-);c点pH=7.19=PKa2,依据平衡常数溶液显碱性,溶液中溶质主要为Na2SO3,SO32-+H2OHSO3-+OH-,Kh=![]() ,c(OH-)=
,c(OH-)=![]() ,带入计算得到:c(HSO32-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3-)。本小题答案为:c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-);>。
,带入计算得到:c(HSO32-)=c(SO32-),溶液中2n(Na)=3c(S),2c(Na+)=3[c(SO32-)+c(H2SO3)+c(HSO3-)]=3[c(H2SO3)+2c(HSO3-)],c(Na+)>3c(HSO3-)。本小题答案为:c(Na+)> c(HSO3-)> c(SO32-)>c(H+)>c(OH-);>。

【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+ 。利用该废液制备过二硫酸铵[( NH4) 2S2O8]和TiO2的一种工艺流程如下:

已知:i.TiOSO4在热水中易水解生成H2TiO3,相关离子形成氢氧化物沉淀的pH范围如 下表:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii. pH>7 时,Fe2+部分生成 Fe( Ⅱ)氨络离Fe(NH3)2]2+o
请回答下列问题:
(1)加入适量Fe的作用是________________ .
(2)生成TiO(OH)2的化学方程式为_______________ 。
(3)滤渣I、滤渣II均含有的物质的化学式为_____________ .
(4)加入H2O2的目的是除掉Fe( Ⅱ)氨络离子[Fe(NH3)2]2+,此过程中氧化剂与还原剂的物质的量之比理论上等于________ (填数值)。
(5)常温下,含硫微粒主要存在形式与pH的关系如下图所示。

用Pt电极电解饱和NH4HSO4溶液制备过二硫酸铵时,为满足在阳极放电的离子主要为 HSO4-,应调节阳极区溶液的pH范围在______之间,其电极反应式为____________ 。
(6)科研人员常用硫酸铁铵[NH4Fe(SO4)2]滴定法测定TiO2的纯度,其步骤为: 用足量酸溶解wg 二氧化钛样品,用铝粉做还原剂,过滤、洗涤,将滤液定容为100 mL,取 25.00 mL,以NH4SCN作指示剂,用标准硫酸铁铵溶液滴定至终点,反应原理为: Ti3++Fe3+=Ti4++Fe2+。
①判断滴定终点的方法:________________________ 。
②滴定终点时消耗c mol/L-1 NH4Fe(SO4)2溶液VmL,则TiO2纯度为___________(写岀相关字母表示的代数式)。
【题目】下表中的实验操作不能达到实验目的或得出相应结论的是
选项 | 实验操作 | 实验目的或结论 |
A | 向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,完全反应后收集H2的体积 | 比较两种酸的电离程度 |
B | 将混有Ca(OH)2杂质的 Mg(OH)2样品放入水中,搅拌,成浆状后,再加入饱和MgCl2溶液,充分搅拌后过滤,用蒸馏水洗净沉淀。 | 除去Mg(OH)2样品中的Ca(OH)2杂质 |
C | 向盛有1mL0.01mol/LAgNO3溶液的试管中滴加5滴0.01mol/L NaCl溶液,有白色沉淀生成,再滴加0.01mol/L NaI溶液,产生黄色沉淀。 | 常温下,Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸测得:0.1mol/LNa2SO3溶液pH约为10,0.1mol/LNaHSO3溶液pH约为5 | HSO3-结合H+的能力比SO32-的弱 |
A. A B. B C. C D. D