题目内容
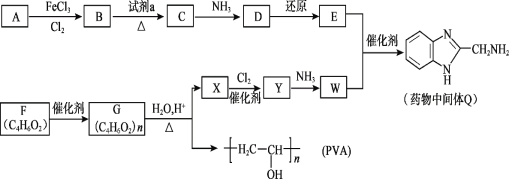
【题目】制备N2H4·H2O(水合肼)和无水Na2SO3主要实验流程如下:

已知:① 氯气与烧碱溶液的反应是放热反应;
② N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
⑴从流程分析,本流程所用的主要有机原料为_______________(写名称)。
⑵步骤Ⅰ制备NaClO溶液时,若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,该反应的离子方程式为____________________。
⑶实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,还可采取的措施是_________________。
⑷步骤Ⅱ合成N2H4·H2O(沸点约118 ℃)的装置如图。NaClO碱性溶液与尿素[CO(NH2)2](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。
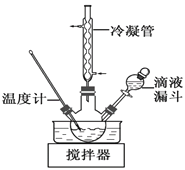
① 使用冷凝管的目的是_________________。
② 滴液漏斗内的试剂是_______;
将滴液漏斗内的液体放入三颈烧瓶内的操作是______________________________;
③ 写出流程中生成水合肼反应的化学方程式________________________________。
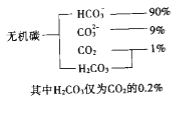
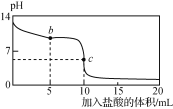
⑸ 步骤Ⅳ制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图所示)。

① 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的pH值为____(取近似整数值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH应控制在________。
【答案】尿素 8Cl2 + 16OH- = 5ClO-+ ClO3- + 10Cl- + 8H2O 冰水浴冷却 通过冷凝回流,减少水合肼的挥发,提高水合肼的产率 NaClO碱性溶液 打开滴液漏斗的活塞,旋转旋塞使漏斗内的液体缓缓流下 NaClO + CO(NH2)2 +2NaOH= NaCl + N2H4 ·H2O + Na2CO3 4 10
【解析】
由实验流程可知,氯气和氢氧化钠溶液的反应生成NaClO,为避免生成NaClO3,应控制温度在40℃以下,生成的NaClO与尿素反应生成N2H4H2O和Na2CO3,可用蒸馏的方法分离出N2H4H2O,副产品Na2CO3溶液中通入二氧化硫,可制得Na2SO3,结合对应物质的性质以及题给信息分析解答。
⑴根据流程图,本流程所用的主要有机原料为尿素,故答案为:尿素;
(2)若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,同时还生成NaCl,根据得失电子守恒,ClO-∶ClO3- ∶Cl- 物质的量之比为5∶1∶10,反应的离子方程式为8Cl2 + 16OH- = 5ClO-+ ClO3- + 10Cl- + 8H2O,故答案为:8Cl2 + 16OH- = 5ClO-+ ClO3- + 10Cl- + 8H2O;
⑶氯气与烧碱溶液的反应是放热反应,实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,避免反应过于剧烈,放出大量的热而导致温度升高,还可以用冰水浴冷却,故答案为:冰水浴冷却;
(4)①为避免N2H4H2O的挥发,使用冷凝管,起到冷凝回流,减少水合肼的挥发,提高水合肼的产率,故答案为:通过冷凝回流,减少水合肼的挥发,提高水合肼的产率;
②为了避免N2H4H2O与 NaClO剧烈反应生成N2,实验中通过滴液漏斗滴加的溶液是NaClO碱性溶液;将滴液漏斗内的液体放入三颈烧瓶内的操作是打开滴液漏斗的活塞,旋转旋塞使漏斗内的液体缓缓流下,故答案为:NaClO碱性溶液;打开滴液漏斗的活塞,旋转旋塞使漏斗内的液体缓缓流下;
③ 根据流程图,NaClO 和CO(NH2)2 在NaOH溶液中反应生成水合肼和碳酸钠,反应的化学方程式为NaClO + CO(NH2)2 +2NaOH= NaCl + N2H4 ·H2O + Na2CO3,故答案为:NaClO + CO(NH2)2 +2NaOH= NaCl + N2H4 ·H2O + Na2CO3;
(5)用Na2CO3制备无水Na2SO3,在Na2CO3溶液中通入过量的二氧化硫生成NaHSO3,然后在NaHSO3溶液中加入NaOH溶液可生成Na2SO3。
①由图像可知,溶液pH约为4时,可完全反应生成NaHSO3,此时可停止通入二氧化硫,故答案为:4;
②由图像可知pH约为10时,可完全反应生成Na2SO3,故答案为:10。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】实验室测定水体中氯离子含量,实验过程如下:向水样中加入K2CrO4溶液作指示剂,用0.0010 mol·L-1AgNO3溶液滴定至终点。已知:Ag2CrO4为不溶于水的砖红色沉淀;常温下Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)= 1.8×10-12。回答下列问题:
(1)滴定时,应使用____________(填“酸式”或“碱式”) 滴定管。
(2)滴定达到终点的标志是___________________________________________。
(3)实验过程中测得数据如下表:
编号 | 1 | 2 | 3 |
V(水样)/mL | 10.00 | 10.00 | 10.00 |
V(AgNO3)/mL | 3.75 | 4.01 | 3.99 |
计算水样中氯离子的含量为_______________mg/L(保留2位小数)
(4)滴定结束后:
①当溶液中的残余c(Cl-)=1.8×10-5mol/L,则此时溶液中c(CrO42-)=____________ mol·L-1。
②已知2AgCl+ CrO42-![]() 2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
2Cl-+Ag2CrO4,计算出该反应的平衡常数为____________。
(5)下列情况会造成实验测定结果偏低的是____________。(填标号)
A.锥形瓶洗涤后未干燥 B.滴定前,未使用标准液润洗滴定管
C.滴定管滴定前仰视读数,滴定后俯视读数
D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡