题目内容
14.解决汽车尾气污染,效果最好的办法是在汽车发动机和排气管之间装一个净化装置,其原理与抽烟用的过滤嘴非常相似,其外形是一个椭圆形的筒,筒内有许多规则的蜂窝状细孔,在蜂窝状的孔壁上涂有用特殊工艺制备的催化剂,当汽车尾气经过这些小孔时,尾气中的一氧化碳和一氧化氮在催化剂作用下发生氧化还原反应,变成两种无害的物质,然后排到大气中.试回答下列问题:(1)写出在催化剂作用下一氧化碳和一氧化氮反应的化学方程式2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(2)请你判断该反应在无催化剂的作用下能否反应?能;(填“能”或“否”)
(3)催化剂对该反应的作用是加快反应速率.
(4)列举几例汽车尾气的危害:①汽车尾气中含有CO、碳氢化合物、NOx等有害气体,是现代大城市的重要污染源之一;②汽车尾气可能会导致光化学烟雾.
分析 (1)CO与NO反应,生成无毒气体为氮气和二氧化碳;
(2)根据催化剂不能使本来不能发生的反应发生来分析;
(3)催化剂只能加快反应速率;
(4)根据汽车尾气的成分来分析.
解答 解:(1)由信息可知,“催化转换器”使CO与NO反应,生成无毒气体为氮气和二氧化碳,该反应为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(2)催化剂不能使本来不能发生的反应发生,故既然反应2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2在有催化剂的条件下能发生,则说明无催化剂也能发生,只是反应速率较慢而已,故答案为:能;
(3)催化剂不能使本来不能发生的反应发生,只能加快反应速率,故答案为:加快反应速率;
(4)汽车尾气中含CO、碳氢化合物、NOx等有害气体,会对空气造成污染,且NOx能导致光化学烟雾,故答案为:①汽车尾气中含有CO、碳氢化合物、NOx等有害气体,是现代大城市的重要污染源之一;②汽车尾气可能会导致光化学烟雾.
点评 本题考查了汽车尾气的污染以及治理,应注意的是催化剂不能使本来不能发生的反应发生,只能加快反应速率.

练习册系列答案
相关题目
4.下表是元素周期表的一部分,元素Z为短周期元素,R的一种核素在考古时常用于鉴定一些文物的年代.下列叙述中正确的是( )
| R | X | |||
| W | Y | Z |
| A. | W的氧化物属于酸性氧化物,与一切酸都不能发生反应 | |
| B. | Z的单质可用于杀灭田鼠 | |
| C. | Y、Z的最高价氧化物对应的水化物的酸性:Y>Z | |
| D. | X、Y的氢化物的沸点:Y>X |
2.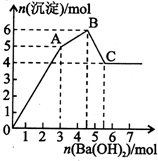 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | ||
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | 据图计算原溶液中c(Cl-)=c(SO42-) | |
| B. | OA段产生的沉淀为BaSO4和Fe(OH)3 | |
| C. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4k+Al(OH)3↓ | |
| D. | C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH- |
9.25℃时,下列各溶液中,离子一定能大量共存的是( )
| A. | 在强碱性溶液中:Na+、K+、AlO2-、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO32- |
8. 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
I.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=+218.4kJ•mol-l
Ⅱ.CaO(s)+3CO(g)+SO2(g?CaS(s)+3CO2(g)△H2=-394.0kJ•mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g)的平衡常数K=$({K}_{1}•{K}_{2})^{\frac{1}{2}}$(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
前20s 内v(SO2)=0.09mo1•L-l•s-l,平衡时CO的转化率为70%.
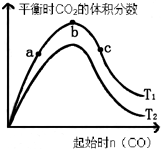
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应II
CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是c.
②图象中T2高于T1(填“高于”、“低于”、“等于”或“无法确定”)判断的理由是反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小,所以T2>T1.
 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:I.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=+218.4kJ•mol-l
Ⅱ.CaO(s)+3CO(g)+SO2(g?CaS(s)+3CO2(g)△H2=-394.0kJ•mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g)的平衡常数K=$({K}_{1}•{K}_{2})^{\frac{1}{2}}$(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
| t/s | 0 | 10 | 20 | 30 | 50 |
| c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应II
CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是c.
②图象中T2高于T1(填“高于”、“低于”、“等于”或“无法确定”)判断的理由是反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小,所以T2>T1.
5.下列有机物的系统名称中,正确的是( )
| A. | 2,4,4-三甲基戊烷 | B. | 4-甲基-2-戊烯 | ||
| C. | 4-甲基-5-乙基庚烷 | D. | 1,2,4-三甲基丁烷 |
6.下列物质中既含有共价键又含离子键的化合物是( )
| A. | NaCl | B. | Al2O3 | C. | NaOH | D. | CH4 |
 已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:
已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题: