题目内容
5.下列有机物的系统名称中,正确的是( )| A. | 2,4,4-三甲基戊烷 | B. | 4-甲基-2-戊烯 | ||
| C. | 4-甲基-5-乙基庚烷 | D. | 1,2,4-三甲基丁烷 |
分析 A、对主链进行编号时,要先从“近”,再从“多”,后从“简”;
B、含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小;
C、对主链进行编号时,要从离支链近的一端开始编号;
D、选主链时,要选最长的碳链为主链.
解答 解:A、2,4,4-三甲基戊烷,该命名不满足取代基编号之和最小,说明编号方向错误,该有机物正确命名为:2,2,4-三甲基戊烷,故A错误;
B、4-甲基-2-戊烯,该命名满足离双键位置最近一端编号,故B正确;
C、庚烷中出现异丙基,说明支链不满足“由简到繁”的原则,故正确命名为:2,2,5-三甲基-3-乙基庚烷,故C错误;
D、1号碳上不能含有甲基,4号碳上不能含有甲基,故此命名说明不是选择的最长碳链,正确命名为:3-甲基己烷,故D错误,
故选B.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性知识的考查,侧重对学生基础知识的检验和训练.

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
13. 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
【查阅资料】
①Cu2+可作为双氧水氧化法破氛处理过程中的催化剂;
②Cu2十在偏碱性条件下对双氧水分解影响较弱,可以忽略不计;
③[Fe(CN)6]3-较CN一难被双氧水氧化,pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
[实脸设计]
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验.
(l)请完成以下实验设计表(表中不要留空格).
【数据处理]
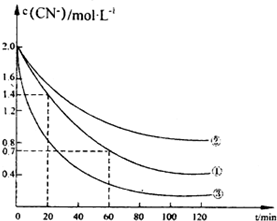
实验测得含氰废水中的总氰浓度(以CN一表示)随时间变化关系如图所示.
(2》实验①中2060min时间段反应速率v(CN-)=0.0175mol•L-1.min-1
【解释和给论]
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化(填一点即可).在偏碱性条件下,含氰废水中的CN一最终被双氧水氧化为HC03,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实脸并验证上述结论,完成下表中内容.
(己知:废水中的CN一浓度可用离子色谱仪测定)
 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).【查阅资料】
①Cu2+可作为双氧水氧化法破氛处理过程中的催化剂;
②Cu2十在偏碱性条件下对双氧水分解影响较弱,可以忽略不计;
③[Fe(CN)6]3-较CN一难被双氧水氧化,pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
[实脸设计]
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验.
(l)请完成以下实验设计表(表中不要留空格).
| 实验序号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考废水的初始pH对 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氯反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 10 |
实验测得含氰废水中的总氰浓度(以CN一表示)随时间变化关系如图所示.
(2》实验①中2060min时间段反应速率v(CN-)=0.0175mol•L-1.min-1
【解释和给论]
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化(填一点即可).在偏碱性条件下,含氰废水中的CN一最终被双氧水氧化为HC03,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实脸并验证上述结论,完成下表中内容.
(己知:废水中的CN一浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
20.在蒸馏水中按物质的量之比为1:1:1:1加入AgNO3,Ba(NO3)2,Na2SO4,NaCl,充分搅拌使之完全溶解,以铂电极电解该溶液,通电后最初的还原产物与氧化产物的质量之比为( )
| A. | 35.5:108 | B. | 1:8 | C. | 108:35.5 | D. | 137:71 |
14.室温时,将盛有NH4HCO3烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸溶液,反应剧烈,大烧杯中的醋酸逐渐凝固(乙酸的熔点:16.6℃),下列说法正确的是( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |
15.一密闭容器中盛有甲烷,在隔绝空气条件下长时间加热到1000℃左右,然后恢复至室温(20℃).这时容器内气体的压强是原来甲烷压强的m倍,原来甲烷的密度是容器内气体密度的n倍.下列判断正确的是( )
| A. | m=2,n=4 | B. | m=0.5,n=4 | C. | m=2,n=0.25 | D. | m=0.5,n=0.25 |