题目内容
8. 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:I.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=+218.4kJ•mol-l
Ⅱ.CaO(s)+3CO(g)+SO2(g?CaS(s)+3CO2(g)△H2=-394.0kJ•mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g)的平衡常数K=$({K}_{1}•{K}_{2})^{\frac{1}{2}}$(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
| t/s | 0 | 10 | 20 | 30 | 50 |
| c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
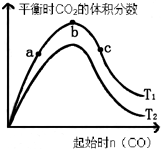
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应II
CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是c.
②图象中T2高于T1(填“高于”、“低于”、“等于”或“无法确定”)判断的理由是反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小,所以T2>T1.
分析 (1)书写反应的平衡常数表达式计算得到平衡常数关系;
(2)依据化学平衡三段式列式计算,再根据v=$\frac{△c}{△t}$进行计算;转化率=$\frac{消耗量}{起始量}×100%$;
(3)①一氧化碳量的增加,平衡正向进行,二氧化硫的转化率增大;
②反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小.
解答 解:(1)I.CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=+218.4kJ•mol-l
Ⅱ.CaO(s)+3CO(g)+SO2(g?CaS(s)+3CO2(g)△H2=-394.0kJ•mol-l
依据盖斯定律计算$\frac{I+Ⅱ}{2}$得反应$\frac{1}{2}$CaSO4(s)+2CO(g)?$\frac{1}{2}$CaS(s)+2CO2(g),
K1=$\frac{c(C{O}_{2})c(S{O}_{2})}{c(CO)}$,K2=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)c(S{O}_{2})}$,K=$\frac{{c}^{2}(C{O}_{2})}{{c}^{2}(CO)}$,
计算得到:K3=$({K}_{1}•{K}_{2})^{\frac{1}{2}}$,
故答案为:$({K}_{1}•{K}_{2})^{\frac{1}{2}}$;
(2)CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)
起始量(mol/L) 3 0 0
变化量(mol/L) 1.8 1.8 1.8
20s量(mol/L) 1.2 1.8 1.8
前20s内v(SO2)=$\frac{1.8mol/L}{20s}$=0.09mol/L•s;
30s达到平衡状态,平衡时CO的转化率=$\frac{3mol/L-0.9mol/L}{3mol/L}$×100%=70%;
故答案为:0.09,70%;
(3))①依据图象分析,随一氧化碳量的增加,二氧化硫的转化率增大,c点最大;
故答案为:c;
②依据平衡移动原理,反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小,所以T2>T1,
故答案为:高于;反应是放热反应,升高温度,平衡逆向进行,二氧化碳含量减小,所以T2>T1.
点评 本题考查了盖斯定律的应用、化学反应速率、转化率和平衡常数的计算,题目难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | 1 molNa2O2中含有的离子总数为4 NA | |
| B. | 0.1 mol羟基(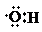 )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,水电离出的OH-的数目为0.1 NA | |
| D. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移的电子数目为3.75 NA |
| A. | 明矾可用于自来水的消毒净化 | |
| B. | Fe2 O3可用作红色油漆和涂料 | |
| C. | 酚醛树脂可用作绝缘、隔热和复合材料 | |
| D. | 硫酸可用于精炼石油以及制取多种挥发性酸 |
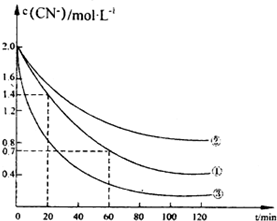 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).【查阅资料】
①Cu2+可作为双氧水氧化法破氛处理过程中的催化剂;
②Cu2十在偏碱性条件下对双氧水分解影响较弱,可以忽略不计;
③[Fe(CN)6]3-较CN一难被双氧水氧化,pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
[实脸设计]
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验.
(l)请完成以下实验设计表(表中不要留空格).
| 实验序号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考废水的初始pH对 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氯反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 10 |
实验测得含氰废水中的总氰浓度(以CN一表示)随时间变化关系如图所示.
(2》实验①中2060min时间段反应速率v(CN-)=0.0175mol•L-1.min-1
【解释和给论]
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化(填一点即可).在偏碱性条件下,含氰废水中的CN一最终被双氧水氧化为HC03,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实脸并验证上述结论,完成下表中内容.
(己知:废水中的CN一浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
| A. | 35.5:108 | B. | 1:8 | C. | 108:35.5 | D. | 137:71 |
| A. | CH3-CH2-CH2-CH2Br | B. | CH2═CH-CH2-CH2-CH2Cl | ||
| C. | CH3Cl | D. | CH2═CH-CH2-C(CH3)2CH2Cl |