题目内容
2.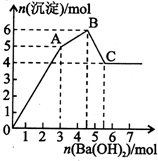 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | ||
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | 据图计算原溶液中c(Cl-)=c(SO42-) | |
| B. | OA段产生的沉淀为BaSO4和Fe(OH)3 | |
| C. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4k+Al(OH)3↓ | |
| D. | C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH- |
分析 向含Al2(SO4)3 和 FeCl3的混合溶液与Ba(OH)2溶液反应的实质是Fe3+,Al3+与OH-、Ba2+与SO42-之间的离子反应,离子方程式为:Ba2++SO42-═BaSO4↓,Fe3++3OH-=Fe(OH)3↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2的物质的量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol.
解答 解:.向含Al2(SO4)3 和 FeCl3的混合溶液与Ba(OH)2溶液反应的实质是Fe3+,Al3+与OH-、Ba2+与SO42-之间的离子反应,离子方程式为:Ba2++SO42-═BaSO4↓,Fe3++3OH-=Fe(OH)3↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2的物质的量为3mol,提供6molOH-,图表分析铁离子先沉淀,由图象分析,OA段为加入3molBa(OH)2,发生反应Ba2++SO42-═BaSO4↓,得到3molBaSO4沉淀,C点为氢氧化铝溶解后的沉淀为氢氧化铁和硫酸钡沉淀共4mol,所以氢氧化铁沉淀为1mol,氢氧化铝沉淀为2mol;分析判断OA段沉淀3mol钡离,1mol铁离子和1mol铝离子;AB段为沉淀1mol铝离子;BC段为溶解氢氧化铝消耗氢氧化钡1mol.
A.由分析可知:FeCl3、Al2(SO4)3的混和溶液中含FeCl31mol,含Al2(SO4)31mol,则c(Cl-)=c(SO42-),故A正确;
B.由分析可知:OA段产生的沉淀为3mol的BaSO4、1mol的Fe(OH)3和1mol的Al(OH)3,故B错误;
C.AB段可能发生的反应是Al3++3OH-→Al(OH)3↓,故C错误;
D.偏铝酸钡是强碱弱酸盐,溶液显碱性,故C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O?Al(OH)3+OH-,故D错误;
故选A.
点评 本题考查化学反应的有关图象问题、铝、铁化合物的性质及混合物的有关计算等,难度较大,了解各阶段发生的反应是解题的关键.

 寒假学与练系列答案
寒假学与练系列答案| A. | 25℃时,O.1 mol•L-1HF溶液pH=l,Ksp(CaF2)随温度和浓度的变化而变化 | |
| B. | 向1L0.2 mol•L-1HF溶液中加入1L O.2 mol•L-1CaCl2溶液,没有沉淀产生 | |
| C. | AgCl不溶于水,不能转化为AgI | |
| D. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于$\frac{1}{\sqrt{1.8}}$×10-11mol•L-1 |
| 微粒 | A | B | C | D |
| 原子核数 | 双核 | 多核 | 多核 | 多核 |
| 所带单位电荷 | -1 | 0 | +1 | 0 |
(1)1个B分子中含有3个σ键;
(2)室温下,等物质的量的B与盐酸反应,写出反应后溶液中溶质的分子式:NH4Cl,该溶质微粒中存在ABD.
A.离子键 B.极性键 C.非极性键 D.配位键
(3)B极易溶于D中的原因是分子间氢键;由于相同的原因,物质E也极易溶于D中,且E分子也含有10个电子.
| A. | 明矾可用于自来水的消毒净化 | |
| B. | Fe2 O3可用作红色油漆和涂料 | |
| C. | 酚醛树脂可用作绝缘、隔热和复合材料 | |
| D. | 硫酸可用于精炼石油以及制取多种挥发性酸 |
| A. | H、C、O、Na | B. | H、K、O、S | C. | H、O、S | D. | H、N、O |
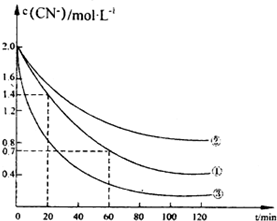 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).【查阅资料】
①Cu2+可作为双氧水氧化法破氛处理过程中的催化剂;
②Cu2十在偏碱性条件下对双氧水分解影响较弱,可以忽略不计;
③[Fe(CN)6]3-较CN一难被双氧水氧化,pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
[实脸设计]
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验.
(l)请完成以下实验设计表(表中不要留空格).
| 实验序号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考废水的初始pH对 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氯反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 10 |
实验测得含氰废水中的总氰浓度(以CN一表示)随时间变化关系如图所示.
(2》实验①中2060min时间段反应速率v(CN-)=0.0175mol•L-1.min-1
【解释和给论]
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化(填一点即可).在偏碱性条件下,含氰废水中的CN一最终被双氧水氧化为HC03,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实脸并验证上述结论,完成下表中内容.
(己知:废水中的CN一浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |