题目内容
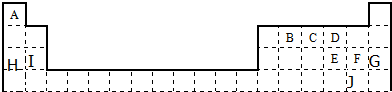
5. 已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:
已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:(1)元素Z在周期表中的位置是第三周期第VIIA族;
(2)YO2气体通入BaCl2 和HNO3的混合溶液中,生成白色沉淀和无色气体WO,有关反应的离子方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+.由此可知YO2和WO还原性由强到弱的顺序是SO2>NO(写化学式).
(3)W是最简单气态氢化物甲的水溶液显碱性,在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3+3H2O2=N2+6H2O.
分析 V、W、X、Y、Z是原子序数依次增大的短周期主族元素,X是地壳中含量最多的金属元素,则X是Al元素;V、Y在周期表中的相对位置如图,根据图知,V为第二周期元素,V元素与氧元素能形成两种无色气体,则V是C元素、Y是S元素;Z的原子序数大于S元素且为短周期主族元素,所以Z是Cl元素,(3)中W的最简单气态氢化物甲的水溶液显碱性,则W是N元素,甲是氨气,
(1)Z为Cl元素,其原子序数为17,最外层为7个电子;
(2)SO2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体NO,发生氧化还原反应生成硫酸根离子和NO,硫酸根离子和钡离子反应生成硫酸钡白色沉淀;同一氧化还原反应中还原剂的还原性大于还原产物的还原性;
(3)氨气和双氧水反应的产物不污染环境,应生成氮气和水.
解答 解:V、W、X、Y、Z是原子序数依次增大的短周期主族元素,X是地壳中含量最多的金属元素,则X是Al元素;V、Y在周期表中的相对位置如图,根据图知,V为第二周期元素,V元素与氧元素能形成两种无色气体,则V是C元素、Y是S元素;Z的原子序数大于S元素且为短周期主族元素,所以Z是Cl元素,(3)中W的最简单气态氢化物甲的水溶液显碱性,则W是N元素,甲是氨气,
(1)Z是Cl元素,其原子最外层有7个电子、3个电子层,位于周期表中第三周期第VIIA族,
故答案为:第三周期第VIIA族;
(2)SO2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体NO,发生氧化还原反应生成硫酸根离子和NO,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,反应方程式为:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+;同一氧化还原反应中还原剂的还原性大于还原产物的还原性,该反应中SO2是还原剂、NO是还原产物,所以二氧化硫的还原性较强,即还原性:SO2>NO,
故答案为:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+;SO2>NO;
(3)氨气和双氧水发生氧化还原反应生成氮气和水,反应方程式为:2NH3+3H2O2=N2+6H2O,故答案为:2NH3+3H2O2=N2+6H2O.
点评 本题考查了位置结构与性质关系的应用,题目难度中等,正确推断各元素名称为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题侧重考查学生的分析、理解能力.

| A. | 氯化钠的电子式: | |
| B. | 聚氯乙烯的结构简式: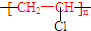 | |
| C. | 硫离子的结构示意图: | |
| D. | 碳酸氢铵的电离方程式:NH4HCO3=NH4++H++CO32ˉ |
| A. | 1 molNa2O2中含有的离子总数为4 NA | |
| B. | 0.1 mol羟基(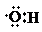 )中含有的电子数为0.7 NA )中含有的电子数为0.7 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,水电离出的OH-的数目为0.1 NA | |
| D. | 在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O中,生成28 g N2时转移的电子数目为3.75 NA |
| 微粒 | A | B | C | D |
| 原子核数 | 双核 | 多核 | 多核 | 多核 |
| 所带单位电荷 | -1 | 0 | +1 | 0 |
(1)1个B分子中含有3个σ键;
(2)室温下,等物质的量的B与盐酸反应,写出反应后溶液中溶质的分子式:NH4Cl,该溶质微粒中存在ABD.
A.离子键 B.极性键 C.非极性键 D.配位键
(3)B极易溶于D中的原因是分子间氢键;由于相同的原因,物质E也极易溶于D中,且E分子也含有10个电子.
| A. | 明矾可用于自来水的消毒净化 | |
| B. | Fe2 O3可用作红色油漆和涂料 | |
| C. | 酚醛树脂可用作绝缘、隔热和复合材料 | |
| D. | 硫酸可用于精炼石油以及制取多种挥发性酸 |