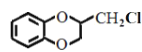
题目内容
【题目】已知下列方程式:8Fe+30HNO3→8Fe(NO3)3+3N2O↑+15H2O
(1)标出上述反应电子转移的方向和总数______。
(2)上述反应中______元素被还原,氧化产物为______,若反应中生成标准状态下的N2O气体2.24L则转移的电子数目为______。
【答案】 +5价的N Fe(NO3)3 0.8NA
+5价的N Fe(NO3)3 0.8NA
【解析】
(1)Fe失去电子,N得到电子,该反应转移24e﹣,则电子转移方向和数目为 ,
,
故答案为: ;
;
(2)N元素的化合价降低,得到电子被还原,+5价的N元素被还原,而Fe失去电子被氧化,氧化产物为Fe(NO3)3,由反应可知,生成3molN2O时转移24mol电子,生成标准状态下的N2O气体2.24L则转移的电子数目为![]() ,
,
故答案为:+5价的N;Fe(NO3)3;0.8NA。

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
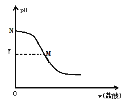
金状元绩优好卷系列答案【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10﹣4 | Ka=5.0×10﹣10 | Ka1=4.3×10﹣7, Ka2=5.6×10﹣11 |
(1)c(H+)相同的三种酸,其酸的浓度从大到小为________________。
(2)0.0lmol/L的HCN溶液中,c(H+)约为_____mol/L。使此溶液中HCN的电离程度增大且c(H+)也增大的方法是_______________________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a_____b(填“大于”、“小于”或“等于”,下同)b。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_____n2。
(4)向NaCN中通入少量的CO2,发生的离子方程式为_______________。
(5)设计实验证明氢氟酸比盐酸的酸性弱__________________。