题目内容
【题目】“碘伏”又叫“聚维酮碘溶液”。聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图所示。下列说法正确的是
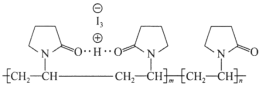 (图中虚线表示氢键)
(图中虚线表示氢键)
A.C、N、O原子的电负性依次增大
B.聚维酮碘中含有离子键、共价键、氢键等化学键
C.聚维酮易溶于水的原因是与水分子间形成氢键
D.分子中的含N五元环一定是平面结构
【答案】AC
【解析】
A.C、N、O的非金属性依次增强,则C、N、O原子的电负性依次增大,故A正确;
B.聚维酮碘中含有离子键、共价键、氢键,但氢键不是化学键,故B错误;
C.因为聚维酮通过氢键与HI3形成聚维酮碘,聚维酮碘中也存在氢键,水分子中也存在氢键,根据相似相溶,聚维酮碘水溶性良好的性能与氢键有关,故C正确;
D.分子中的含N五元环上有3个亚甲基,亚甲基上的碳原子为sp3杂化,则五元环一定不是平面结构,故D错误;
故答案为AC。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】已知反应2X(g)+Y(g)![]() Z(g),某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
Z(g),某研究小组将4moX和2molY置于一容积不变的密闭容器中,测定1min内X的转化率,得到的数据如表所示,下列判断正确的是( )
t/min | 2 | 4.5 | 5 | 6 |
X的转化率 | 30% | 40% | 70% | 70% |
A.随着反应的进行,混合气体的密度不断增大
B.反应在5.5min时,v正(X)=v逆(Z)
C.6min时,容器中剩余1.4 mol Y
D.若反应过程中,容器内压强不再改变,可以说明该反应已达到平衡状态
【题目】下列表格中的各种情况,可以用右图的曲线表示的是 ( )
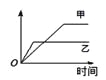
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. AB. BC. CD. D
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为____________。
②下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液
c 加水稀释 d 加入少量醋酸钠晶体
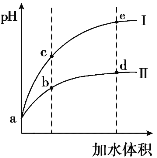
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
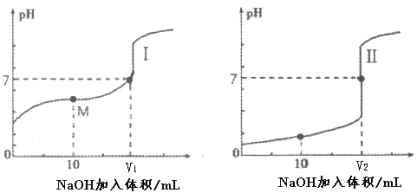
①滴定醋酸的曲线是___________(填“I”或“Ⅱ”)。
②滴定开始前,0.1 mol·L-1 NaOH、0.1 mol·L-1的盐酸和0.1 mol·L-1醋酸三种溶液中由水电离出的c(H+)最大的是_______溶液。
③图I中,V=10时,溶液中的c(H+)_________c(OH-) (填“>”、“=”或“<”,下同),c(Na+)_________c(CH3COO-)。
(3)下表为某同学所测25℃时,甲、乙两种溶液的pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =___________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲_____乙。
③甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲_____乙。
(4)煤炭工业中经常会产生大量SO2,为防止污染环境,常采用吸收法进行处理。以下物质可用于吸收SO2的是____________。
A H2O2 B Na2CO3 C Na2SO3 D Ca(OH)2
(5)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离 常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
/span>
以下反应对应的离子方程式正确的是___________。
A Na2CO3溶液吸收少量SO2:CO32-+SO2+H2O = SO32-+HCO3-
B 漂白液生效的原理:ClO-+CO2+H2O = HClO+HCO3-
C 次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+SO32-
D 醋酸除水垢中的CaCO3:2CH3COOH+CaCO3 = Ca2++2CH3COO-+H2O+CO2↑