题目内容
【题目】氨是重要的基础化工原料,可以制备尿素[CO(NH2)2]、N2H4等多种含氮的化工产品。
(1)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:![]()
反应Ⅱ:![]()
反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1
则反应:![]() __________kJ/mol
__________kJ/mol
(2)将氨气与二氧化碳在有催化剂的反应器中反应![]() ,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:
,体系中尿素的产率和催化剂的活性与温度的关系如图1所示:

①a点________(填是或不是)处于平衡状态,T1之后尿素产率下降的原因是___________________________。
②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比![]() 、水碳比
、水碳比![]() 的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
的变化关系。曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是___________,测得b点氨的转化率为30%,则x=___________________。
③已知该反应的![]() ,
,![]() ,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
,k(正)和k(逆)为速率常数,则平衡常数K与k(正),k(逆)的关系式是____________________________________。
(3)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:
![]() ;
;
![]()
①25℃时,向N2H4水溶液中加入H2SO4,欲使![]() ,同时
,同时![]() ,应控制溶液pH范围_____________(用含a、b式子表示)。
,应控制溶液pH范围_____________(用含a、b式子表示)。
②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为_______________。
【答案】-87.0 不是 升高温度反应逆向移动;催化剂活性降低 Ⅰ 4 ![]() 14-b<pH<14-a N2H6(HSO4)2
14-b<pH<14-a N2H6(HSO4)2
【解析】
(1)已知:
反应I:![]()
反应Ⅱ:![]()
反应Ⅲ:H2O(1)=H2O(g) △H3=+44.0 kJ·mol-1
NH3与CO2合成尿素同时生成液态水的化学方程式为2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l),根据盖斯定律I+II-III得2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l),则△H=-159.5kJmol-1+(+116.5kJmol-1)-(+44.0kJmol-1)=-87.0 kJmol-1;
(2)①产率最高之前,未达到平衡状态,反应为放热反应,达到平衡之后,升高温度,平衡逆向移动,产率下降,且催化剂活性降低;
②氨碳比相同时曲线Ⅲ二氧化碳的转化率大,所以曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是为Ⅰ;由题意可知:
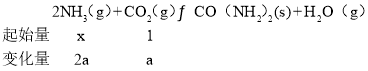
即![]() ,
,![]() =0.6,则x=4;
=0.6,则x=4;
③当V正=V逆时反应达到平衡,即![]() ,此时平衡常数K=
,此时平衡常数K=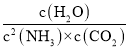 =
=![]() ;
;
(3)①N2H4+H2ON2H5++OH- K1=1×10-a;N2H5++H2ON2H62++OH- K2=1×10-b,可知K1= 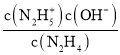 =1×10-a,K2=
=1×10-a,K2= 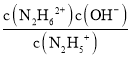 =1×10-b,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),则1×10-b<c(OH-)<1×10-a,即应控制溶液pH范围为14-b<pH<14
=1×10-b,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),则1×10-b<c(OH-)<1×10-a,即应控制溶液pH范围为14-b<pH<14
②既然水合肼的性质类似一水合氨,在水中应该能电离产生N2H62+和OH-,因此它的硫酸酸式盐的化学式为(N2H6)(HSO4)2。

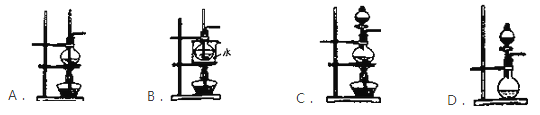
【题目】利用下图装置可以进行实验并能达到实验目的的是
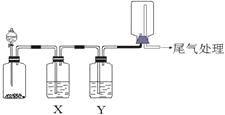
选项 | 实验目的 | X中试剂 | Y中试剂 |
A[] | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 验证电石与饱和食盐水反应生成的气体的性质并收集 | CuSO4溶液 | KMnO4 |
D | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
A. A B. B C. C D. D
【题目】人类生活离不开化学,以下是补铁剂和胃药的两张标签的部分信息。
硫酸亚铁片 英文名:Ferrous Sulfate Tablets 本品含硫酸亚铁(FeSO4·7H2O)应为标示量的95.0%~110.0% | 氢氧化铝片 英文名:Aluminium Hydroxide Tablets |
(主要成分)糖衣、碳酸镁、氢氧化铝、淀粉 | |
(性状)本品为糖衣,除去糖衣后显淡绿色 | (适应症)能缓解胃酸过多 |
(鉴别)取本品,除去糖衣,称取适量(约相当于硫酸亚铁片0.2g),加稀盐酸1滴与水20mL,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应 | (用法用量)成人:口服,一次0.6~0.9g(一次2~3片),一日3次,餐前1小时服用 |
(详细用法)详见说明书 |
I、根据“硫酸亚铁片”标签回答问题:
(1)硫酸亚铁片溶于水后溶液的颜色是_______________。
(2)硫酸盐中检验![]() 的离子反应方程式是______________________________________。
的离子反应方程式是______________________________________。
(3)鉴别中,“加稀盐酸1滴”的作用是__________________________________________。
(4)检验硫酸亚铁片是否被氧化的方法是________________________________________。
II、根据“氢氧化铝片”标签回答问题:
(1)能缓解胃酸过多的成分是__________________________________________。
(2)氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的______________。
A. 酸性 B. 碱性 C. 两性 D. 氧化性
(3)写出氢氧化铝的电离方程式:_____________________________________________。
【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大