��Ŀ����
9�� ��ĿǰΪֹ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ�õ�����Ҫ����Դ��
��ĿǰΪֹ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ�õ�����Ҫ����Դ����1����25�桢101kPa�£�16g�ļ״���CH3OH����ȫȼ������CO2��Һ̬ˮʱ�ų�352kJ�����������ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O��l����H=-704kJ•mol-1
��2����ѧ��Ӧ�зų������ܣ��ʱ䣬��H���뷴Ӧ���������ļ��ܣ�E���йأ�
��֪��H2 ��g��+Cl2 ��g���T2HCl ��g����H=-185kJ/mol��
E��H-H��=436kJ/mol��E��Cl-Cl��=243kJ/mol��E��H-Cl��=432kJ/mol
��3������Cu2O���ھ��������Ĵ����ܶ��ܵ���ע����֪��
2Cu��s��+$\frac{1}{2}$O2��g���TCu2O��s����H=-169kJ•mol-1��
C��s��+$\frac{1}{2}$O2��g���TCO��g����H=-110.5kJ•mol-1��
2Cu��s��+O2��g���T2CuO��s����H=-314kJ•mol-1
��ҵ����̿���ڸ��������»�ԭCuO��ȡCu2O��CO���Ȼ�ѧ����ʽΪC��s��+2CuO��s��=Cu2O��s��+CO��g����H=+34.5KJ/mol��
��4������ͼ��N2��H2��Ӧ����2mol NH3�����������仯ʾ��ͼ�������ÿ����1mol NH3�ų�����Ϊ��46.1kJ��
������ʼʱ�������ڷ���1mol N2��3mol H2����ƽ���N2��ת����Ϊ20%����Ӧ�ų�������ΪQ1 kJ����Q1����ֵΪ18.44��
���� ��1��16g�ļ״���CH3OH�����ʵ���=$\frac{16g}{32g/mol}$=0.5mol��0.5mol�ļ״���CH3OH����ȫȼ������CO2��Һ̬ˮʱ�ų�352kJ����������1mol�ļ״���CH3OH����ȫȼ������CO2��Һ̬ˮʱ�ų�704kJ��������
��2�����ݷ�Ӧ�ʱ�=��Ӧ������ܺ�-����������ܺͼ���õ���
��3�������Ȼ�ѧ����ʽ��˹���ɼ���õ������Ȼ�ѧ����ʽ��
��4��������ͼ�����������2mol������Ӧ�ʱ�=���ѻ�ѧ����������-�γɻ�ѧ���ų���������õ�1mol�����ų�������
�����ݻ�ѧƽ��������ɰ������ʵ���������Ȼ�ѧ����ʽ����Q1��
��� �⣺��1��16g�ļ״���CH3OH�����ʵ���=$\frac{16g}{32g/mol}$=0.5mol��0.5mol�ļ״���CH3OH����ȫȼ������CO2��Һ̬ˮʱ�ų�352kJ����������1mol�ļ״���CH3OH����ȫȼ������CO2��Һ̬ˮʱ�ų�704kJ���������Ȼ�ѧ��Ӧ����ʽΪ��CH3OH ��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O ��l����H=-704 kJ•mol-1��
�ʴ�Ϊ��CH3OH ��l��+$\frac{3}{2}$O2��g��=CO2��g��+2H2O ��l����H=-704 kJ•mol-1��
��2���ʱ��H=��Ӧ������ܺ�-����������ܺͣ�H2 ��g��+Cl2 ��g��=2HCl ��g����H=-185kJ/mol��E��H-H��=436kJ/mol��E��Cl-Cl��=243kJ/mol��
E��H-H��+E��Cl-Cl��-2E��H-Cl��=��H��
��E��H-Cl��=432 kJ/mol��
�ʴ�Ϊ��432 kJ/mol��
��3����2Cu��s��+$\frac{1}{2}$O2��g���TCu2O��s����H=-169kJ•mol-1��
��C��s��+$\frac{1}{2}$O2��g���TCO��g����H=-110.5kJ•mol-1��
��2Cu��s��+O2��g���T2CuO��s����H=-314kJ•mol-1
���ݸ�˹���ɢ�+��-�۵õ���ҵ����̿���ڸ��������»�ԭCuO��ȡCu2O��CO���Ȼ�ѧ����ʽΪ��C��s��+2CuO��s��=Cu2O��s��+CO��g����H=+34.5 KJ/mol��
�ʴ�Ϊ��C��s��+2CuO��s��=Cu2O��s��+CO��g����H=+34.5 KJ/mol��
��4������ͼ��N2��H2��Ӧ����2mol NH3�����������仯ʾ��ͼ����Ӧ�ʱ��H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol����������1mol��������46.1KJ��
�ʴ�Ϊ��46.1 kJ��
����ͼ��N2��H2��Ӧ����2mol NH3�����������仯ʾ��ͼ����Ӧ�ʱ��H=335KJ/mol-427.2KJ/mol=-92.2KJ/mol��
N2��g��+3H2��g��=2NH3��g����H=-92.2KJ/mol
1 3 0
0.2 0.6 0.4
����0.4mol��������=$\frac{0.4mol}{2mol}$��92��2KJ=18.44KJ��
�ʴ�Ϊ��18.44��
���� ���⿼�����Ȼ�ѧ����ʽ��˹���ɵļ���Ӧ�ã���Ӧ���ܼ�������ʱ䣬ͼ��������⣬ע�ⷴӦ�ʱ���������⣬���ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

| A�� | �����ڢ�A��Ԫ�� | B�� | �����������ᣬ��������ǿ����Һ | ||
| C�� | �ڳ����£���������������Ӧ | D�� | ���ǵؿ��к������Ľ���Ԫ�� |
| A�� | 17.4g | B�� | 46.8g | C�� | 40.8g | D�� | 23.4g |
| A�� | ���ߵĵ����ڳ����¶�������Ũ�����Ũ���� | |
| B�� | ���ߵĵ��ʷ����ڿ����о�ֻ���������� | |
| C�� | ��������Ӧ������������ˮ�ж������ܽ�ƽ�� | |
| D�� | ��ҵ���Ʊ������ֽ����ķ�������Ϊ��ⷨ���ȷֽⷨ���Ȼ�ԭ�� |
| A�� | ����������Һ����ˮԡ�ϼ��� | |
| B�� | �������������ɫʯ����Һ | |
| C�� | ������Ȼ������������ʵ�ˮ��Һ����������Ӧʵ�� | |
| D�� | �ȼ���������NaOH��Һ��Ȼ���������������ʵ�ˮ��Һ����������Ӧʵ�� |
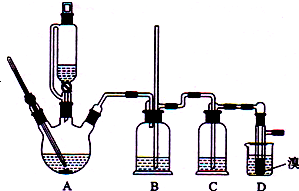 ʵ�����Ʊ�1��2-�������飨��ɫҺ�壬�۵�9�棬�ܶ�2.2g•cm-3���ķ�Ӧԭ�����£�
ʵ�����Ʊ�1��2-�������飨��ɫҺ�壬�۵�9�棬�ܶ�2.2g•cm-3���ķ�Ӧԭ�����£�