题目内容
【题目】碳元素形成的有机化合物在动植物体内及人类生存环境中有着相当广泛的存在,起着非常重要的作用。请结合下列有关含碳化合物的研究,完成下列填空。
(1)为了高效利用能源并且减少CO2的排放,可用下列方法把CO2转化成甲醇燃料:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=akJmol1
②2H2(g)+O2(g)=2H2O(g) △H=bkJmol1
③CH3OH(g)=CH3OH(l) △H=ckJmol1
④H2O(g)=H2O(l) △H=dkJmol1
则表示CH3OH(l)燃烧热的热化学方程式为___。
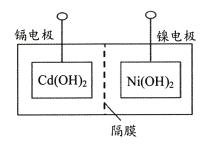
(2)用甲醇燃料电池电解处理酸性含铬废水(主要含有Cr2O72),用如图装置模拟该过程:
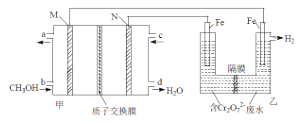
①请完成电解池中Cr2O72转化为Cr3+的离子方程式___。
②当甲池中消耗甲醇1.6g时,乙池中两电极的质量差为___g。
(3)葡萄糖和果糖为同分异构体,在一定条件下,C6H12O6(葡萄糖)![]() C6H12O6(果糖) △H﹤0。该反应的速率方程式可表示为v(正)=k(正)c(葡)、v(逆)=k(逆)c(果),k(正)和k(逆)在一定温度下为常数,分别称作正、逆反应速率常数。T1温度下,k(正)=0.06s1,k(逆)=0.002s1。
C6H12O6(果糖) △H﹤0。该反应的速率方程式可表示为v(正)=k(正)c(葡)、v(逆)=k(逆)c(果),k(正)和k(逆)在一定温度下为常数,分别称作正、逆反应速率常数。T1温度下,k(正)=0.06s1,k(逆)=0.002s1。
①T1温度下,该反应的平衡常数K1=___。
②该反应的活化能Ea(正)___Ea(逆)(填“大于”、“小于”或“等于”)。
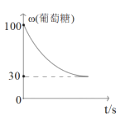
③该T2温度下,从开始反应到平衡的过程中,葡糖糖的质量分数变化如图所示。可以确定温度T2___T1(填“大于”、“小于”或“等于”)。
(4)H2A为二元弱酸。室温下配制一系列c(H2A)+c(HA)+c(A2)=0.100molL1的H2A与NaOH的混合溶液。测得H2A、HA、A2的物质的量分数c(x)%(c(x)%=![]() ×100%)随pH变化如图所示。
×100%)随pH变化如图所示。
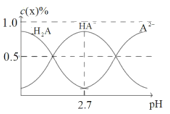
①当c(Na+)=0.100molL1时,溶液中离子浓度的大小顺序为___。
②室温下,若将0.100molL1的H2A与amolL1的NaOH溶液等体积混合,使溶液的pH=7。则H2A的Ka2=___molL1(用a表示)。
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=
O2(g)=CO2(g)+2H2O(l) △H=![]() -a-c(或-a+1.5b-c+2d) Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 8.4 30 小于 大于 c(Na+)﹥c(HA-)﹥c(H+)﹥c(A2-)﹥c(OH-)
-a-c(或-a+1.5b-c+2d) Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 8.4 30 小于 大于 c(Na+)﹥c(HA-)﹥c(H+)﹥c(A2-)﹥c(OH-) ![]()
【解析】
(1)利用盖斯定律推算出CH3OH(l)燃烧热的热化学方程式;
(2)甲池为甲醇燃料电池,其中M为负极,N为正极;乙池为电解池,乙池中左边铁为阳极,右边的铁为阴极,阳极产生的Fe2+还原Cr2O72-,将Cr2O72转化为Cr3+;利用串联电路中转移的电子数相等,计算当甲池中消耗甲醇1.6g时,乙池中两电极的质量差;
(3)①根据速率方程式,当达到平衡时,v(正)= v(逆),k(正)c(葡) = k(逆)c(果),该反应的平衡常数K=![]() =
=![]() ,然后根据k(正)和k(逆)在一定温度下的数值,带入计算;
,然后根据k(正)和k(逆)在一定温度下的数值,带入计算;
②根据该反应为放热反应,故正反应的活化能小于逆反应的活化能;
③根据图像信息,计算T2温度下的平衡常数,然后与T1温度下的平衡常数相比,对应放热反应而言,温度越高平衡常数越小;
(4)①当c(Na+)=0.100molL1时,H2A与NaOH恰好反应生成NaHA,结合图中的信息,溶液中离子浓度的大小;
②由电荷守恒可知,c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),由物料守恒可知c(H2A)+c(HA)
+c(A2)=0.050molL1,结合图像信息,计算出c(HA-)、c(A2-)、c(H+),然后计算H2A的Ka2=![]() 。
。
(1)利用盖斯定律:1.5×②-①-③+2×④,得CH3OH(l)燃烧热的热化学方程式:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=(-a+1.5b-c+2d) kJmol1;
O2(g)=CO2(g)+2H2O(l) △H=(-a+1.5b-c+2d) kJmol1;
(2)①乙池中左边铁为阳极,其电极反应式为Fe-2e-= Fe2+,Fe2+还原Cr2O72-,将Cr2O72转化为Cr3+,其反应方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
②1.6gCH3OH的物质的量为![]() =0.05mol,M为负极,其电极反应式为CH3OH-6e-+ H2O= 6H++ CO2↑,n(e-)=6n(CH3OH)=6×0.05mol=0.3mol,串联电路中转移的电子数相等,乙池中左边铁为阳极,其电极反应式为Fe-2e-= Fe2+,故消耗Fe的物质的量为0.15mol,乙池中左边铁消耗的质量为0.15mol×56g/mol=8.4g,右边的铁为阴极,电极反应式为2 H++2e-= H2↑,即右边的铁电极的质量不变,所以当甲池中消耗甲醇1.6g时,乙池中两电极的质量差为8.4g;
=0.05mol,M为负极,其电极反应式为CH3OH-6e-+ H2O= 6H++ CO2↑,n(e-)=6n(CH3OH)=6×0.05mol=0.3mol,串联电路中转移的电子数相等,乙池中左边铁为阳极,其电极反应式为Fe-2e-= Fe2+,故消耗Fe的物质的量为0.15mol,乙池中左边铁消耗的质量为0.15mol×56g/mol=8.4g,右边的铁为阴极,电极反应式为2 H++2e-= H2↑,即右边的铁电极的质量不变,所以当甲池中消耗甲醇1.6g时,乙池中两电极的质量差为8.4g;
(3)①根据速率方程式,当达到平衡时,v(正)= v(逆),k(正)c(葡) = k(逆)c(果),该反应的平衡常数K=
![]() =
=![]() ,T1温度下,k(正)=0.06s1,k(逆)=0.002s1,故T1温度下,K=
,T1温度下,k(正)=0.06s1,k(逆)=0.002s1,故T1温度下,K=![]() =30;
=30;
②室温下,若将0.100molL1的H2A与amolL1的NaOH溶液等体积混合,使溶液的pH=7,c(H+)=10-7 molL1,由电荷守恒可知,c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-),因为溶液呈中性,c(H+)=c(OH-),c(Na+)= c(HA-)+2c(A2-)=0.5a molL1,由物料守恒可知c(H2A)+c(HA)+c(A2)
=0.050molL1,结合图像信息,当溶液呈中性时,c(H2A)比较小,忽略不计,c(A2)=(0.5a-0.050) molL1,c(HA)=(0.1-0.5a) molL1,室温下,Ka2=![]() =
=![]() =
=![]() 。
。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
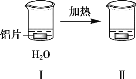
暑假作业安徽少年儿童出版社系列答案【题目】探究铝片与Na2CO3溶液的反应。
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
下列说法不正确的是
A. Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH-
B. 对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C. 推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D. 加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的