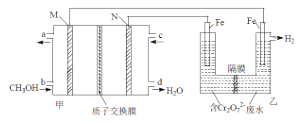
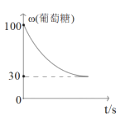
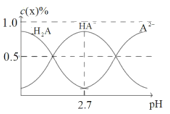
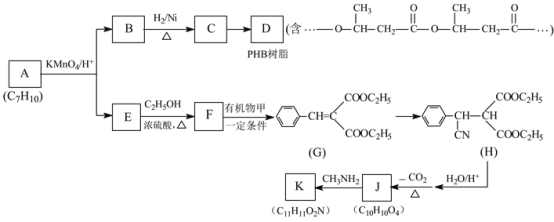
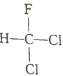
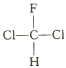
题目内容
【题目】硫和锌及其化合物用途广泛。回答下列问题:
(1)基态硫原子的价电子排布图为___________。
(2)已知基态锌、铜的电离能如表所示:
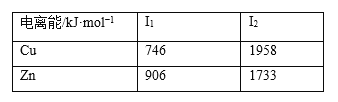
由表格数据知,I2(Cu)>I2(Zn)的原因是__________。
(3)H2O分子中的键长比H2S中的键长______(填“长”或“短”)。H2O分子的键角比H2S的键角大,其原因是_______。
(4)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S32-的空间构型为_________。
(5)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为______。
),则噻吩分子中的大π键应表示为______。
②噻吩的沸点为84 ℃,吡咯(![]() )的沸点在129~131 ℃之间,后者沸点较高,其原因是___。1 mol吡咯含____mol σ键。
)的沸点在129~131 ℃之间,后者沸点较高,其原因是___。1 mol吡咯含____mol σ键。
(6)硫化锌是一种半导体材料,其晶胞结构如图所示。
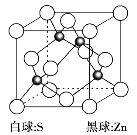
已知:硫化锌晶体密度为d g·cm3,NA代表阿伏加德罗常数的值,则Zn2和S2之间的最短核间距(x)为_________nm(用代数式表示)。
【答案】![]() Zn 失去第二个电子达到 3d10 稳定结构,而 Cu 失去第一个电子即达到稳定结构 短 氧原子半径小于硫,水分子中成键电子对之间排斥力大于 H2S V 形
Zn 失去第二个电子达到 3d10 稳定结构,而 Cu 失去第一个电子即达到稳定结构 短 氧原子半径小于硫,水分子中成键电子对之间排斥力大于 H2S V 形 ![]() 吡咯分子间存在氢键 10
吡咯分子间存在氢键 10 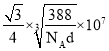
【解析】
(1)硫为16号元素,据此书写价电子排布图;
(2)Zn 为30号元素,价电子排布式为1s22s22p63s23p63d104s2, Cu为29号元素,价电子排布式为1s22s22p63s23p63d104s1,据此分析I2(Cu) >I2(Zn) 的原因;
(3)O原子半径比S原子半径小;O的电负性大于S,键合电子对偏向O,据此分析解答;
(4)根据价层电子对个数=σ键个数+孤电子对个数计算S32-的中心原子S的价层电子对数分析判断;
(5)①噻吩(![]() )分子为平面结构,环中存在两根π键,S的pz轨道中一对电子与环上的π电子共轭,形成离域大π键,据此分析解答;②吡咯环中存在N,N的电负性较S大,吡咯能形成分子间氢键;根据吡咯(
)分子为平面结构,环中存在两根π键,S的pz轨道中一对电子与环上的π电子共轭,形成离域大π键,据此分析解答;②吡咯环中存在N,N的电负性较S大,吡咯能形成分子间氢键;根据吡咯(![]() )的结构判断1 mol吡咯含有的σ键数;
)的结构判断1 mol吡咯含有的σ键数;
(6)根据均摊法计算晶胞中Zn、S原子数目,确定晶胞质量,根据晶胞的密度计算晶胞棱长,Zn2和S2之间的最短核间距(x)为体对角线长度的![]() ,据此分析计算。
,据此分析计算。
(1)硫为16号元素,最外层有6个电子,价电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)Zn 为30号元素,价电子排布式为1s22s22p63s23p63d104s2,失去第二个电子达到 3d10 稳定结构,而 Cu为29号元素,价电子排布式为1s22s22p63s23p63d104s1,失去第一个电子即达到稳定结构,使得I2(Cu) >I2(Zn) ,故答案为:Zn 失去第二个电子达到 3d10 稳定结构,而 Cu 失去第一个电子即达到稳定结构;
(3)O原子半径比S原子半径小,使得H2O分子中的键长比H2S中的键长短;O的电负性大于S,键合电子对偏向O,键合电子对与键合电子对间斥力增大,键角增大,使得H2O分子中的键角∠HOH 比H2S分子中的键角∠HSH 大,故答案为:短:氧原子半径小于硫,水分子中成键电子对之间排斥力大于 H2S;
(4)单质硫与热的NaOH 浓溶液反应的产物之一为Na2S3,S32-属多硫链的一种,S32-的中心原子S的价层电子对数=2+![]() =4,采用sp3杂化,中心原子形成2个σ键、还有2个孤电子对,因此S32-的空间构型为V形,故答案为:V形;
=4,采用sp3杂化,中心原子形成2个σ键、还有2个孤电子对,因此S32-的空间构型为V形,故答案为:V形;
(5)①噻吩(![]() )分子为平面结构,环中存在两根π键,S原子价电子排布式为3s23p4,S的pz轨道中一对电子与环上的π电子共轭,形成离域大π键,形成五中心六电子的离域大π键,记为
)分子为平面结构,环中存在两根π键,S原子价电子排布式为3s23p4,S的pz轨道中一对电子与环上的π电子共轭,形成离域大π键,形成五中心六电子的离域大π键,记为![]() ,故答案为:
,故答案为:![]() ;
;
②噻吩的沸点为84℃,吡咯( ![]() )的沸点在129~131℃之间,后者沸点较高,因为吡咯环中存在N,N的电负性较S大,吡咯能形成分子间氢键使沸点升高,而噻吩分子间不能形成氢键,根据吡咯(
)的沸点在129~131℃之间,后者沸点较高,因为吡咯环中存在N,N的电负性较S大,吡咯能形成分子间氢键使沸点升高,而噻吩分子间不能形成氢键,根据吡咯(![]() )的结构可知,1 mol吡咯含有4molC-H键、1molC-C键、2molC=C键、2molC-N键、1molN-H键,共含10mol σ键,故答案为:吡咯分子间存在氢键;10;
)的结构可知,1 mol吡咯含有4molC-H键、1molC-C键、2molC=C键、2molC-N键、1molN-H键,共含10mol σ键,故答案为:吡咯分子间存在氢键;10;
(6)晶胞中Zn原子数目=4、S原子数目=8×![]() +6×
+6×![]() =4,晶胞质量=
=4,晶胞质量=![]() =
=![]() g,设晶胞棱长为 a nm,则dgcm-3×(a×10-7 cm)3=
g,设晶胞棱长为 a nm,则dgcm-3×(a×10-7 cm)3=![]() g,解得a=
g,解得a=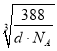 ×107 nm,Zn2和S2之间的最短核间距(x)为体对角线长度的
×107 nm,Zn2和S2之间的最短核间距(x)为体对角线长度的![]() ,因此Zn2和S2之间的最短核间距(x)为
,因此Zn2和S2之间的最短核间距(x)为![]() ×
×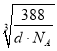 ×107 nm,故答案为:
×107 nm,故答案为:![]() ×
×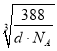 ×107 。
×107 。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是( )
A. 实验时的温度T2高于T1
B. 2号Cu2O的催化效率比1号Cu2O的催化效率高
C. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1
D. 等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关