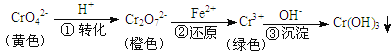题目内容
【题目】某学习小组为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。
①完成本实验需要不断用玻璃棒搅拌,其目的是_______________________________。
②若实验前所称样品的质量为m g,加热至恒重时固体质量为a g,则样品中纯碱的质量分数为________。
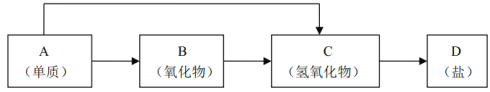
(2)方案二:按如图所示装置进行实验,并回答下列问题:
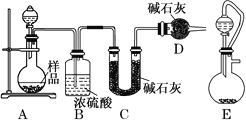
①实验前先检查装置的气密性,并称取一定质量的样品放入A中,将稀硫酸装入分液漏斗中。D装置的作用是________________。
②实验中除称量样品质量外,还需分别称量_______装置反应前、后质量(填装置字母代号)。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显的缺陷,该缺陷是_________。
④有同学认为,用E装置替代A装置能提高实验准确度。你认为是否正确?_________(填“是”或“否”)。
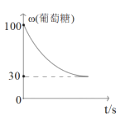
(3)方案三:称取一定量的样品置于锥形瓶中,加适量水,用盐酸进行滴定,从开始至有气体产生到气体不再产生,所滴加的盐酸体积如图所示,则小苏打样品中纯碱的质量分数为_________(保留两位有效数字)。

【答案】使固体样品受热均匀,避免局部温度过高,造成样品外溅![]() ×100%避免空气中的水蒸气和二氧化碳进入C装置中,造成实验误差C反应产生的二氧化碳残留在A、B装置内,不能被完全吸收否24%
×100%避免空气中的水蒸气和二氧化碳进入C装置中,造成实验误差C反应产生的二氧化碳残留在A、B装置内,不能被完全吸收否24%
【解析】
试题小苏打久置会发生反应:2NaHCO3![]() Na2CO3+CO2↑+H2O,该样品成分为NaHCO3、Na2CO3,测定样品中纯碱的质量分数方法有:测定二氧化碳的质量、测定碳酸钠的质量、测定碳酸氢钠的质量.
Na2CO3+CO2↑+H2O,该样品成分为NaHCO3、Na2CO3,测定样品中纯碱的质量分数方法有:测定二氧化碳的质量、测定碳酸钠的质量、测定碳酸氢钠的质量.
(1)①使用玻璃棒搅拌,使固体受热均匀,避免局部温度过高,造成固体外溅,
故答案为:使固体受热均匀,避免局部温度过高,造成固体外溅;
②设样品中碳酸氢钠的质量为x,则:
2NaHCO3![]() Na2CO3+CO2↑+H2O 质量减少
Na2CO3+CO2↑+H2O 质量减少
168 62
x (m-a)g
则x=![]() =
=![]() g,故m(Na2CO3)=[m-
g,故m(Na2CO3)=[m-![]() ]g,
]g,
则样品中Na2CO3的质量分数为{[m-![]() ]g÷mg}×100%=
]g÷mg}×100%=![]() ×100%。
×100%。
故答案为:![]() ×100%;
×100%;
(2)①利用C中碱石灰增重测定反应生成二氧化碳的质量,进而计算样品中碳酸钠的质量分数,由于碱石灰可以吸收空气中的二氧化碳与水蒸气,故D装置的作用是吸收空气中的二氧化碳与水蒸气,避免空气中的二氧化碳与水蒸气加入C中,防止测定误差。故答案为:避免空气中的二氧化碳与水蒸气加入C中,造成实验误差;
②C装置反应前后质量之差为反应生成二氧化碳的质量,根据样品总质量、二氧化碳的质量可以计算混合物中碳酸钠的质量,还需分别称量C装置反应前、后的质量。故答案为:C;
③该实验装置有一个明显的缺陷是反应产生的二氧化碳残留在A、B装置内,不能完全被吸收,使C中吸收二氧化碳质量减小,造成较大的误差。故答案为:反应产生的二氧化碳残留在A、B装置内,不能完全被吸收;
④有同学认为,用E装置替代A装置能提高实验准确度,这种说法不正确。因为,E装置用恒压分液漏斗,部分二氧化碳为残留在分液漏斗上部,使C中吸收二氧化碳质量减小,造成较大的误差。故答案为:否;
(3)由图可知,开始发生反应:Na2CO3+HCl=NaHCO3,产生二氧化碳的反应为:HCl+NaHCO3![]() NaCl+CO2↑+H2O,横坐标每个刻度为50mL,令每个刻度为1molHCl,由方程式可知,样品中n(Na2CO3)=1mol,碳酸钠反应生碳酸氢钠为1mol,故原样品中碳酸氢钠的物质的量为5mol-1mol=4mol,则原混合物中碳酸钠的质量分数为
NaCl+CO2↑+H2O,横坐标每个刻度为50mL,令每个刻度为1molHCl,由方程式可知,样品中n(Na2CO3)=1mol,碳酸钠反应生碳酸氢钠为1mol,故原样品中碳酸氢钠的物质的量为5mol-1mol=4mol,则原混合物中碳酸钠的质量分数为![]() ×100%=24%。故答案为:24%.
×100%=24%。故答案为:24%.

【题目】汽车尾气中含有CO、NO等有害气体。
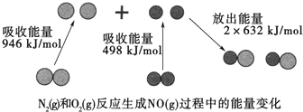
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会________(填“吸收”或“放出”)________kJ能量。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请将表中数据补充完整:a___________。
②能验证温度对化学反应速率规律的是实验____________________(填实验序号)。
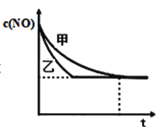
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________(填“甲”或“乙”)。
④在容积固定的容器中发生反应2NO+2CO![]() 2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内CO浓度不变 B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2) D.容器内混合气体密度保持不变
【题目】下列离子方程式正确且与对应操作和目的相符的是
选项 | 目的 | 操作 | 离子方程式 |
A | 比较Fe2+和Br还原性强弱 | 向FeBr2溶液中加入少量氯水 | 2Br+Cl2=Br2+2Cl |
B | 比较C、Si非金属性强弱 | 向硅酸钠溶液中通入少量二氧化碳 | SiO32-+CO2+H2O=H2SiO3↓+ CO32- |
C | 除去CO2中的SO2 | 将气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | CO32-+SO2=SO32-+CO2 |
D | 实验室制取氯气 | 向MnO2固体中加入浓盐酸并加热 |
|
A. AB. BC. CD. D
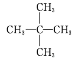
【题目】现有下列几组物质:
① | ② | ③ | ④ |
12C、14C | CH3CH3、CH3CH2CH3 | CH3CH2CH3、 |
|
(1)互为同系物的是________(填序号,下同)。
(2)互为同分异构体的是______。
(3)互为同位素的是_______。
(4)属于同一种物质的是________。