题目内容
【题目】写出下列有机物的系统命名或结构简式:
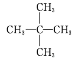
(1) ![]() _________________
_________________
(2)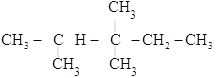 ________________
________________
(3)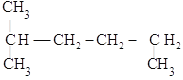 __________
__________
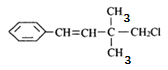
(4)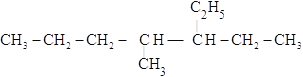 ______________
______________
(5)2,2-二甲基-3-乙基己烷____________________
(6)1,1,2,2-四氯丙烷____________________
【答案】2,3-二甲基戊烷 2,3,3-三甲基戊烷 2-甲基己烷 4-甲基-3-乙基庚烷 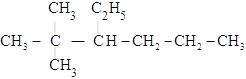
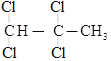
【解析】
根据烷烃的命名原则,先选最长碳链为主链;然后从离支链最近一端编号;简单的写在前面,复杂的写在后面,书写名称,据此分析解答(1)~(4);先根据名称确定主链碳原子数,再从一端编号,在对应碳原子上连接取代基,最后补充氢原子得到结构简式,据此分析解答(5)~(6)。
(1)![]() 的最长碳链含有5个C,主链为戊烷,编号从左边开始,在2、3号C上各含有一个甲基,该有机物命名为:2,3-二甲基戊烷,故答案为:2,3-二甲基戊烷;
的最长碳链含有5个C,主链为戊烷,编号从左边开始,在2、3号C上各含有一个甲基,该有机物命名为:2,3-二甲基戊烷,故答案为:2,3-二甲基戊烷;
(2)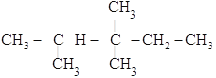 的最长碳链含有5个C,主链为戊烷,编号从左边开始,在2号C上含有一个甲基,3号C上含有两个甲基,该有机物命名为:2,3,3-三甲基戊烷,故答案为:2,3,3-三甲基戊烷;
的最长碳链含有5个C,主链为戊烷,编号从左边开始,在2号C上含有一个甲基,3号C上含有两个甲基,该有机物命名为:2,3,3-三甲基戊烷,故答案为:2,3,3-三甲基戊烷;
(3)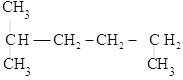 的最长碳链含有6个C,主链为己烷,编号从左边开始,在2号C上含有一个甲基,该有机物命名为:2-甲基己烷,故答案为:2-甲基己烷;
的最长碳链含有6个C,主链为己烷,编号从左边开始,在2号C上含有一个甲基,该有机物命名为:2-甲基己烷,故答案为:2-甲基己烷;
(4) 的最长碳链含有7个C,主链为庚烷,编号从右边开始,在4号C上含有一个甲基,在3号C上含有一个乙基,该有机物命名为:4-甲基-3-乙基庚烷,故答案为:4-甲基-3-乙基庚烷;
的最长碳链含有7个C,主链为庚烷,编号从右边开始,在4号C上含有一个甲基,在3号C上含有一个乙基,该有机物命名为:4-甲基-3-乙基庚烷,故答案为:4-甲基-3-乙基庚烷;
(5)2,2-二甲基-3-乙基己烷的主链含有6个碳原子,在2号C上含有两个甲基,在3号C上含有一个乙基,结构简式为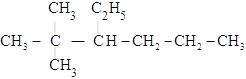 ,故答案为:
,故答案为: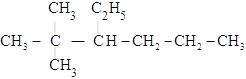 ;
;
(6)1,1,2,2-四氯丙烷的主链含有3个碳原子,在1号C上含有两个氯原子,在2号C上含有两个氯原子,结构简式为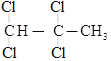 ,故答案为:
,故答案为: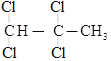 。
。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案【题目】下列离子方程式正确且与对应操作和目的相符的是
选项 | 目的 | 操作 | 离子方程式 |
A | 比较Fe2+和Br还原性强弱 | 向FeBr2溶液中加入少量氯水 | 2Br+Cl2=Br2+2Cl |
B | 比较C、Si非金属性强弱 | 向硅酸钠溶液中通入少量二氧化碳 | SiO32-+CO2+H2O=H2SiO3↓+ CO32- |
C | 除去CO2中的SO2 | 将气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | CO32-+SO2=SO32-+CO2 |
D | 实验室制取氯气 | 向MnO2固体中加入浓盐酸并加热 |
|
A. AB. BC. CD. D
【题目】现有下列几组物质:
① | ② | ③ | ④ |
12C、14C | CH3CH3、CH3CH2CH3 | CH3CH2CH3、 |
|
(1)互为同系物的是________(填序号,下同)。
(2)互为同分异构体的是______。
(3)互为同位素的是_______。
(4)属于同一种物质的是________。