题目内容
(8分)查阅有关资料知:铝与氢氧化钠溶液反应实际是分以下两步进行:
第1步:2Al+6H2O=2Al(OH)3+3H2↑ 第2步:Al(OH)3+NaOH=Na[Al(OH)4]
试回答下列问题:
(1)铝与氢氧化钠溶液反应的离子方程式为: 。
(2)判断两步反应的反应类型(用四种基本反应类型作答)
①第1步属 ,②第2步属 。
(3)根据你的分析,铝与氢氧化钠溶液反应中氧化剂是 ,
还原剂是___________。
(4)若将 Na[Al(OH)4] +4HCl = AlCl3 + NaCl + 4H2O 分两步进行,请写出第1步的化学方程式。
第1步:
第2步:Al(OH)3 + 3HCl = AlCl3 + 3H2O
第1步:2Al+6H2O=2Al(OH)3+3H2↑ 第2步:Al(OH)3+NaOH=Na[Al(OH)4]
试回答下列问题:
(1)铝与氢氧化钠溶液反应的离子方程式为: 。
(2)判断两步反应的反应类型(用四种基本反应类型作答)
①第1步属 ,②第2步属 。
(3)根据你的分析,铝与氢氧化钠溶液反应中氧化剂是 ,
还原剂是___________。
(4)若将 Na[Al(OH)4] +4HCl = AlCl3 + NaCl + 4H2O 分两步进行,请写出第1步的化学方程式。
第1步:
第2步:Al(OH)3 + 3HCl = AlCl3 + 3H2O
(1)2Al + 2OH- +6H2O = 2[Al(OH)4]- +3H2↑ (2分)
(2)置换反应(1分) 化合反应(1分) (3)H2O(1分) Al (1分)
(4)Na[Al(OH)4] + HCl =" NaCl" +Al(OH)3↓+ H2O(2分)
(2)置换反应(1分) 化合反应(1分) (3)H2O(1分) Al (1分)
(4)Na[Al(OH)4] + HCl =" NaCl" +Al(OH)3↓+ H2O(2分)
(1)①+②*2就会消去Al(OH)3,得到铝与氢氧化钠溶液反应的方程式;
(3) 得到铝与氢氧化钠溶液反应中氧化剂是H2O,还原剂为Al;
得到铝与氢氧化钠溶液反应中氧化剂是H2O,还原剂为Al;
(4)总反应方程式减去第二步化学方程式,就会得到第一步化学方程式:Na[Al(OH)4] + HCl =" NaCl" +Al(OH)3↓+ H2O。
(3)
 得到铝与氢氧化钠溶液反应中氧化剂是H2O,还原剂为Al;
得到铝与氢氧化钠溶液反应中氧化剂是H2O,还原剂为Al;(4)总反应方程式减去第二步化学方程式,就会得到第一步化学方程式:Na[Al(OH)4] + HCl =" NaCl" +Al(OH)3↓+ H2O。

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
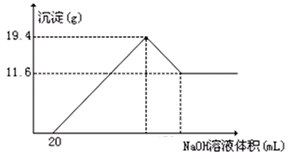
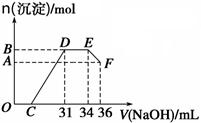
 测定生成气体的体积为69.44L(标准状况)
测定生成气体的体积为69.44L(标准状况) 过滤,测定沉淀的质量为5.8g
过滤,测定沉淀的质量为5.8g