题目内容
9.亚铝酸钠(NaClO2)可用以下流程制备.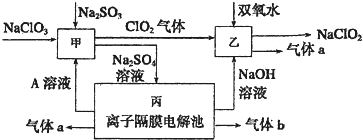
(1)A的化学式是H2SO4,甲中发生反应的化学方程式为Na2SO3+2NaClO3+H2SO4=2ClO2↑+2Na2SO4+H2O.
(2)乙中反应的离子方程式是2ClO2+H2O2+2OH-═2ClO2-+O2↑+2H2O.
(3)装置丙产生气体b的电极反应式为2H++2e-=H2↑.
分析 由流程图可知反应甲反应物为NaClO3、Na2SO3、加入A溶液,产生C1O2、Na2SO4溶液,应在酸性条件下进行,则A为酸,反应离子方程式为2H++SO32-+2ClO3-=2C1O2+SO42-+H2O,丙是离子隔膜电解池,从反应甲知该电解有酸生成、从丙知有碱生成,有两种气体生成,所以丙为电解硫酸钠本质是电解水,A为硫酸,a为氧气,b为氢气,C1O2与过氧化氢在碱性条件下反应生成NaClO2和氧气,以此解答该题.
解答 解:由流程图可知反应甲反应物为NaClO3、Na2SO3、加入A溶液,产生C1O2、Na2SO4溶液,应在酸性条件下进行,则A为酸,反应离子方程式为2H++SO32-+2ClO3-=2C1O2+SO42-+H2O,丙是离子隔膜电解池,从反应甲知该电解有酸生成、从丙知有碱生成,有两种气体生成,所以丙为电解硫酸钠本质是电解水,A为硫酸,a为氧气,b为氢气,C1O2与过氧化氢在碱性条件下反应生成NaClO2和氧气,
(1)由以上分析可知甲为H2SO4,反应物为NaClO3、Na2SO3、加入硫酸,产生C1O2、Na2SO4溶液,反应的化学方程式为Na2SO3+2NaClO3+H2SO4=2 ClO2↑+2Na2SO4+H2O,
故答案为:H2SO4; Na2SO3+2NaClO3+H2SO4=2 ClO2↑+2Na2SO4+H2O;
(2)根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,H2O2是还原剂,发生氧化反应,反应的离子方程式为2ClO2+H2O2+2OH-═2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-═2ClO2-+O2↑+2H2O;
(3)b为氢气,在电解池的阴极生成,电极方程式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑.
点评 本题考查生产NaClO2的制备实验的工业设计,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,把握物质的性质熟练运用氧化还原反应为解答该题的关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 甲苯的一氯代物有4中,甲苯与氢气完全加成后产物的一氯代物有5种 | |
| B. | 糖类、油脂、蛋白质在一定条件下均可以水解 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. | 漂粉精和医用酒精均可用作消毒剂 |
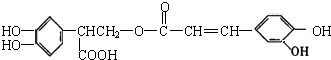
| A. | 迷迭香酸能使酸性高锰酸钾及溴的四氯化碳溶液褪色,属于芳香烃 | |
| B. | 迷迭香酸的分子式为C18H15O8,其在碱性条件下的水解反应叫皂化反应 | |
| C. | 迷迭香酸分子中含有5种官能团 | |
| D. | 1mol迷迭香酸跟H2反应,最多可消耗7molH2 |
| A. | 物质的量浓度相等的HA和NaA溶液等体积混合,溶液呈碱性:c(A-)<c(HA) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | pH=3的HCl和pH=11的氨水等体积混合后:c(Cl-)>c(NH4+) | |
| D. | 1.0mol/L Na2CO3溶液:2c(CO32-)+c(HCO3-)+c(OH-)-c(H+)=2.0mol/L |

| A. | X的分子式为C5H10O2,该产物属于羧酸的同分异构体有5种 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 | |
| D. | 可用酸性高锰酸钾溶液区分苯和X |
| A. | 负极铝被氧化 | |
| B. | 海水温度升高,电池反应速率可能加快 | |
| C. | 正极制成仿鱼鳃的网状结构的目的是增大正极材料和氧气接触面积 | |
| D. | 正极电极反应式为O2+4H++4e-=2H2O |
| A. | H2O是一种弱电解质 | B. | CO2是一种温室气体 | ||
| C. | HCOOH是一种一元弱酸 | D. | 该研究中能量转化方式只有1种 |
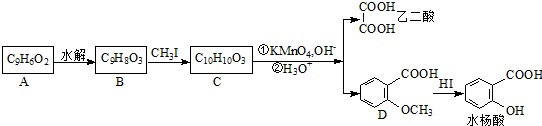
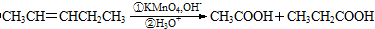
 .
.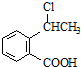 可以最终合成芳香内酯A,其中前两步的反应是
可以最终合成芳香内酯A,其中前两步的反应是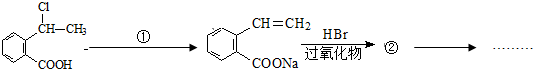
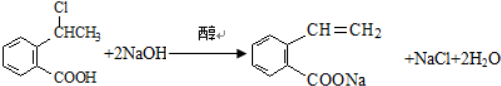 ,产物②的结构简式是
,产物②的结构简式是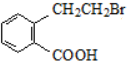 .
. 燃烧是我们非常熟悉的化学反应.
燃烧是我们非常熟悉的化学反应.