题目内容
8.物质的量浓度都是0.1mol/L的CH3COOH和CH3COONa混合溶液,已知其中c(CH3COO-)>c(Na+),对该溶液的下列判断正确的是( )| A. | c(H+)<c(OH-) | B. | c(CH3COOH)+c(CH3COO-)=0.2mol/L | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COO-)+c(OH-)=0.1mol/L |
分析 等物质的量浓度的醋酸和醋酸钠溶液中,c(CH3COO-)>c(Na+),根据电荷守恒知:c(H+)>c(OH-),说明醋酸的电离程度大于其水解程度,则c(CH3COOH)<c(CH3COO-);溶液中存在物料守恒:c(CH3COOH)+c(CH3COO-)=2c(Na+)=0.2mol/L,据此对各选项进行判断.
解答 解:A.等物质的量浓度的醋酸和醋酸钠溶液中,c(CH3COO-)>c(Na+),根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),所以c(H+)>c(OH-),故A错误;
B.溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.2 mol•L-1,故B正确;
C.混合溶液呈酸性,则醋酸的电离程度大于醋酸根离子水解程度,所以c(CH3COOH)<c(CH3COO-),故C错误;
D.根据电荷守恒得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),钠离子不水解,所以钠离子浓度为0.1mol/L,则c(CH3COO-)+c(OH-)=c(Na+)+c(H+)>0.1mol/L,故D错误;
故选B.
点评 本题考查了离子浓度大小的比较,题目难度中等,根据电荷守恒确定溶液的酸碱性及酸的电离程度和酸根离子水解程度相对大小,再结合电荷守恒和物料守恒解答,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
19.下列说法错误的是( )
| A. | 煤的气化、液化和干馏都属于化学变化 | |
| B. | 石油的裂化可以提高轻质油的产量和质量 | |
| C. | 石油分馏可获得乙烯、丙烯 | |
| D. | 苯等有机物是从煤干馏产物中分离出来的 |
16.根据表中维生素C的有关信息,回答下列问题
(1)小明同学在超市中购买了以下食品:苹果、西红柿、薯片、牛肉干,上述食品中,富含维生素C的是苹果、西红柿;
(2)维生素C是一种水溶性维生素,其水溶液显酸性(填“酸”或“碱”),服用补铁(Fe2+)制剂时医生常建议同时服用维生素C,这是因为维生素C具有还原(填“氧化”或“还原”)性;生吃新鲜蔬菜要比熟吃时维生素C的损失小,因为维生素C在受热时很容易被氧化 (填“氧化”或“还原”);
(3)维生素C对于治疗下列哪种疾病比较有效A.
A.坏血病 B.脑炎 C.骨折 D.肺炎.
| 分子式 | C6H806 |
| 物理特性 | 可口酸味 |
| 化学特性 | 还原性,易被氧化 |
| 重要功能 | 抗坏血病 |
| 主要存在 | 新鲜水果,绿色蔬菜 |
(2)维生素C是一种水溶性维生素,其水溶液显酸性(填“酸”或“碱”),服用补铁(Fe2+)制剂时医生常建议同时服用维生素C,这是因为维生素C具有还原(填“氧化”或“还原”)性;生吃新鲜蔬菜要比熟吃时维生素C的损失小,因为维生素C在受热时很容易被氧化 (填“氧化”或“还原”);
(3)维生素C对于治疗下列哪种疾病比较有效A.
A.坏血病 B.脑炎 C.骨折 D.肺炎.
3.下列说法中正确的是( )
| A. | H2和D2互为同位素 | B. | 正丁烷和异丁烷互为同系物 | ||
| C. | 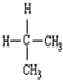 与 与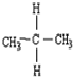 互为同分异构体 互为同分异构体 | D. | 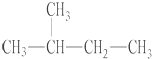 和 和 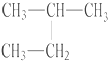 是同一种物质 是同一种物质 |
20.能用于鉴别甲烷和乙烯的试剂是( )
| A. | 盐酸 | B. | 酸性高锰酸钾溶液 | ||
| C. | NaOH溶液 | D. | CCl4 |
17.用NA表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 1 mol的氢氧根离子所含电子数均为9 NA | |
| B. | 1.00 mol NaCl中含有NA个NaCl分子 | |
| C. | 常温常压下,92g的NO2和N2O4的混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA |
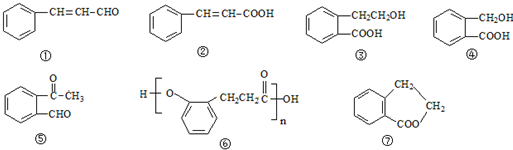
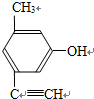 .
.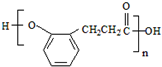 +2nNaOH→n
+2nNaOH→n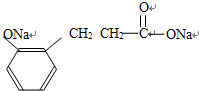 +(n+1)H2O.
+(n+1)H2O.
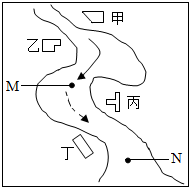 学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现:
学环保监测小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如图所示,这些工厂向小河排放的废水中各含一种化合物,经检测发现: