��Ŀ����
����Ŀ����2HI��g��![]() H2��g��+I2��g���У����ַ��ӻ�ѧ������ʱ�����仯��ͼ1��ʾ������������ͬ��1 mol HI�ڲ�ͬ�¶ȷֽ��ƽ��ʱ�������ϵ��I2���ʵ������¶ȱ仯��������ͼ2��ʾ��
H2��g��+I2��g���У����ַ��ӻ�ѧ������ʱ�����仯��ͼ1��ʾ������������ͬ��1 mol HI�ڲ�ͬ�¶ȷֽ��ƽ��ʱ�������ϵ��I2���ʵ������¶ȱ仯��������ͼ2��ʾ��
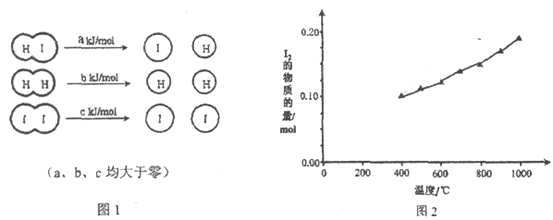
��1���Ƚ�2a________b+c���<������>����=������������________________��
��2��ij�¶��¸÷�Ӧƽ�ⳣ��Ϊ1��64����ƽ��ʱ��1 mol HI�ֽ��ת����Ϊ________________��
��3�������ô˷�Ӧ�Ʊ�I2�������HIת���ʵĴ�ʩ��________������ĸ��ţ���
a. ����I2 b. ��ѹ c. ���� d. ����HIŨ��
���𰸡� > ������������ʱ�������¶ȣ�n��I2�����ӣ�����ӦΪ���ȷ�Ӧ������ 2a>b+c 20�� ac
����������1����ͼ2�õ��������¶����ߣ�I2�����ʵ��������������������¶�ƽ�������ƶ�������Ӧ�������������ȷ�Ӧ��Ӧ���Ƿ�Ӧ����ܼ��ܣ���Ӧʱ�ϼ����յ�������������������ܼ��ܣ�����ʱ�ɼ��ų�����������2a��b+c��
��2��������Ŀ���ݽ������¼��㣺
2HI��g��![]() H2��g��+ I2��g��
H2��g��+ I2��g��
��ʼ�� 1 0 0
��Ӧ�� 2X X X
ƽ���� 1-2X X X
������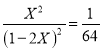 �� X=0.1�����Է�Ӧ��HIΪ0.2mol��ת����Ϊ20%��
�� X=0.1�����Է�Ӧ��HIΪ0.2mol��ת����Ϊ20%��
��3������I2ƽ�������ƶ���HIת�������ߣ�ѡ��a��ȷ���÷�Ӧ���������ʵ�������ķ�Ӧ������ѹǿ��Ӱ��ƽ��̬��ѡ��b���÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���HI��ת�������ߣ�ѡ��c��ȷ�������£�������������ʵ�������ķ�Ӧ��ֻҪ��֤Ͷ�ϱ���Ⱦ��ǵ�Чƽ�⡣�÷�Ӧ�ķ�Ӧ��ֻ��һ�֣����ۼӶ��ٶ���Ͷ�ϱ���ȣ���������HI��Ũ�Ⱥ�ʵ�ʽ���һ����Чƽ��̬��HI�ķֽ�ת���ʲ��䣬ѡ��d����

����Ŀ��I. �����£���3��һԪ��ֱ��NaOH��Һ�������ϣ�ʵ���������£�
��� | c��һԪ�ᣩ��c��H+�� | c��NaOH����mol/L | �����Һ��pH |
�� | c��H+��=0.1 mol��L��HX�� | 0.1 | pH=a |
�� | c��HY��=0.1mol��L | 0.1 | pH=7 |
�� | c��HZ��=0.1 mol��L | 0.1 | pH=9 |
��1������ʵ����HXΪ���ᣬa______7���<������=����>������
��2������ʵ����HY��Һ��pH=______��
��3������ʵ�鷢����Ӧ�����ӷ���ʽΪ__________________��
������Һ����ˮ�������c��OH-��=______mol/L��
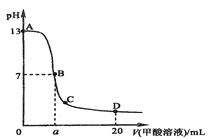
II. ��0.1 mol��L-1 NaOH��Һ�ֱ���������Ϊ20 mL��Ũ�Ⱦ�Ϊ0.1 mol��L-1 HCl��Һ��HA��Һ����Һ��pH�����NaOH��Һ����仯��ͼ��
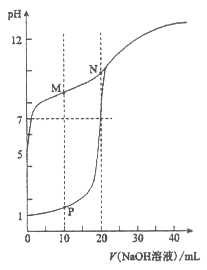
��1��HAΪ_______�ᣨ�ǿ������������
��2��N��pH>7��ԭ���ǣ������ӷ���ʽ��ʾ��_________��
��3������˵����ȷ����_______ ������ĸ����
a. M��c��HA��-��
b. M��c��Na+��>c��OH-��
c. P��c��Cl-��=0.05 mol��L-1
��4��NaA��NaOH��Ũ�ȵ�������ʱ����Һ��c��A-��______c��OH-�����<������=����>����