题目内容
【题目】下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法将在杂质除去,并写出相应的方程式(①②写离子方程式,③写化学方程式)。
物质 | 杂质 | 试剂/方法 | 离子/化学方程式 |
①FeCl2 | CuCl2 | ____ | _______ |
②Fe(OH)3 | Al(OH)3 | ____ | _______ |
③Al2O3 | Al(OH)3 | ____ | _______ |
【答案】铁粉 Cu2++Fe= Fe2++ Cu 氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O 加热 2Al(OH)3 ![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
①过量的铁粉与CuCl2反应生成FeCl2和Cu,过滤即可除去杂质,因此加入的试剂为铁粉,发生的离子反应为:Cu2++Fe= Fe2++ Cu;
②Al(OH)3能与氢氧化钠溶液反应生成偏铝酸钠和水,而Fe(OH)3不与氢氧化钠溶液反应,因此可用氢氧化钠溶液除去Fe(OH)3中混有的Al(OH)3,离子反应为:Al(OH)3+OH-=AlO2-+2H2O;
③Al(OH)3受热分解可得Al2O3,因此混合物受热分解即可除去杂质,反应方程式为:2Al(OH)3 ![]() Al2O3+3H2O。
Al2O3+3H2O。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
【题目】向两份等体积、等浓度,pH不同的FeSO4,溶液中逐滴加入NaClO溶液,实验测得溶液pH随加入NaClO溶液体积变化曲线如下图,实验现象如下表。下列说法不正确的是()
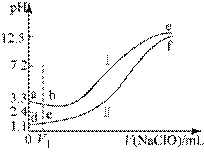
实验 | 实验现象 |
Ⅰ | 滴入V1mL NaClO溶液产生大量红褪色沉淀 |
Ⅱ | 滴入V1mL NaClO溶液,溶液变黄,未见沉淀,继续滴加出现红褪色沉淀 |
A.a~b段主要反应的离子方程式为:![]()
B.d~e段主要反应的离子方程式为:![]()
C.c、f点pH接近的主要原因是:![]()
D.向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出