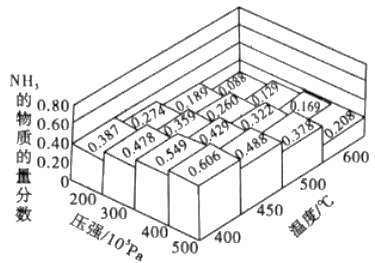
题目内容
【题目】向含有5×10-3molHIO3 与少量淀粉的溶液中通入H2S,溶液变蓝且有S析出,继续通入H2S,溶液的蓝色褪去,则在整个过程中( )
A. 共得到0.96g硫 B. 通入H2S的体积为336mL
C. 碘元素先被还原后被氧化 D. 转移电子总数为3.0×10-2 NA
【答案】D
【解析】A、HIO3与少量淀粉的溶液中通入H2S,HIO3具有氧化性,能将硫化氢氧化生成硫单质,本身被还原为碘单质,所以溶液变蓝且有S析出,根据得失电子守恒有2HIO3~5H2S~5S,所以5×10-3molHIO3被消耗,最终生成碘离子,得到的硫的质量是![]() ×32g=0.48g,故A错误;B、整个过程中,根据电子守恒、原子守恒,得到HIO3~3H2S~3S~I-,所以5×10-3molHIO3被消耗,就会消耗0.015mol的H2S,标况下体积为336mL,但题目未注明是否为标准状况,故B错误;C、HIO3与少量淀粉的溶液中通入H2S,HIO3具有氧化性,与硫化氢反应生成硫单质和碘单质,H2S被氧化,继续通入H2S,H2S会和碘单质发生反应,碘单质消失,H2S被氧化,故C错误;D、整个过程中,根据电子守恒、原子守恒,得到HIO3~3H2S~3S~I-~6e-,消耗5×10-3molHIO3伴随0.03mol电子转移,转移电子总数为3.0×10-2NA,故D正确;故选D。
×32g=0.48g,故A错误;B、整个过程中,根据电子守恒、原子守恒,得到HIO3~3H2S~3S~I-,所以5×10-3molHIO3被消耗,就会消耗0.015mol的H2S,标况下体积为336mL,但题目未注明是否为标准状况,故B错误;C、HIO3与少量淀粉的溶液中通入H2S,HIO3具有氧化性,与硫化氢反应生成硫单质和碘单质,H2S被氧化,继续通入H2S,H2S会和碘单质发生反应,碘单质消失,H2S被氧化,故C错误;D、整个过程中,根据电子守恒、原子守恒,得到HIO3~3H2S~3S~I-~6e-,消耗5×10-3molHIO3伴随0.03mol电子转移,转移电子总数为3.0×10-2NA,故D正确;故选D。

【题目】二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺. 
(1)①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2 . 写出阳极产生ClO2的电极反应式: . ②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为mol.
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2﹣离子.电池工作时正极反应为 .
(3)若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/molL﹣1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为mol.