题目内容
6.在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体恰好反应后,再加入足量的铁粉充分反应.所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为( )| A. | 1.5mol/L | B. | 2mol/L | C. | 1mol/L | D. | 无法确定 |
分析 该反应过程为:2FeCl3+H2S→2FeCl2+S↓+2HCl,生成的盐酸再和铁反应生成氯化亚铁,所以最终溶液中的溶质是氯化亚铁,根据氯原子守恒计算氯化铁的物质的量浓度.
解答 解:该反应过程为:2FeCl3+H2S→2FeCl2+S↓+2HCl,生成的盐酸再和铁反应生成氯化亚铁,所以最终溶液中的溶质是氯化亚铁,
根据氯原子守恒计算氯化铁的物质的量浓度,
所得溶液经测定金属阳离子的浓度为3mol/L,则c(FeCl2)=3mol/L,
根据氯原子守恒知,c(FeCl3)=c(FeCl2)×$\frac{2}{3}$=3mol/L×$\frac{2}{3}$=2mol/L,
故选B.
点评 本题考查了物质的量的有关计算,明确反应实质是解本题关键,然后利用原子守恒进行分析解答即可,难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
17.“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是( )
| A. | Al在氧气中生成Al2O3,Fe在氧气中也生成Fe2O3 | |
| B. | 第VA族氢化物的熔沸点顺序是NH3>AsH3>PH3;则第 VIA族氢化物的熔沸点顺序也是H2O>H2Se>H2S | |
| C. | 工业上用电解熔融的氯化镁制备镁单质,工业上也可用电解熔融的氯化铝制备铝单质 | |
| D. | BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
14.等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为2:3,则甲、乙两烧杯中的反应情况可能分别是( )
| A. | 甲、乙中都是铝过量 | B. | 甲中铝过量、乙中碱过量 | ||
| C. | 甲中酸过量、乙中铝过量 | D. | 甲中酸过量、乙中碱过量 |
1.下列化学用语描述中正确的是( )
| A. | 含18个中子的氯原子的核素符号:${\;}_{35}^{17}$Cl | |
| B. | 比例模型 可以表示CO2 分子或SiO2分子 可以表示CO2 分子或SiO2分子 | |
| C. | HCO${\;}_{3}^{-}$的电离方程式为:HCO${\;}_{3}^{-}$+H2O?CO${\;}_{3}^{2-}$+H3O+ | |
| D. | 次氯酸的结构式:H-Cl-O |
18.下列说法正确的是( )
| A. | 用含有铁粉的透气小袋与食品一起密封包装,铁粉是常用的干燥剂 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 硫酸铝与碳酸氢钠能制作泡沫灭火剂,二者可快速反应产生二氧化碳气体 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |
15.某同学想用实验证明FeCl3溶液显黄色不是Cl-造成的,下列实验中无意义的是( )
| A. | 观察KCl溶液没有颜色 | |
| B. | 加水稀释后FeCl3溶液黄色变浅 | |
| C. | 向FeCl3溶液中滴加适量无色硝酸银溶液,振荡后静置,溶液黄色未消失 | |
| D. | 向FeCl3溶液中滴加适量氢氧化钠溶液,振荡后静置,溶液黄色消失 |
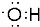 ;
;