题目内容
1.用一种试剂就能鉴别出乙醇、乙酸、甲酸和葡萄糖四种有机物的水溶液,该试剂是( )| A. | 银氨溶液 | B. | 金属钠 | ||
| C. | FeCl3溶液 | D. | 新制的Cu(OH)2碱性悬浊液 |
分析 四种物质都溶于水,乙酸和甲酸具有酸性,葡萄糖和甲酸含有醛基,可与新制氢氧化铜悬浊液在加热条件下发生氧化还原反应,以此鉴别.
解答 解:A.银氨溶液不能鉴别葡萄糖和甲酸,故A错误;
B.四种溶液都含有水,都可与钠反应生成氢气,不能鉴别,故B错误;
C.氯化铁都四种物质都不反应,不能鉴别,故C错误;
D.乙醇与新制氢氧化铜悬浊液不反应,乙酸与新制氢氧化铜悬浊液发生中和反应,沉淀溶解,葡萄糖与新制氢氧化铜悬浊液在加热条件下发生氧化还原反应生成砖红色沉淀,甲酸与新制氢氧化铜悬浊液发生中和反应,沉淀溶解,在加热条件下发生氧化还原反应生成砖红色沉淀,可鉴别,故D正确.
故选D.
点评 本题考查物质的检验和鉴别,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同,注重基础知识的学习,难度不大.

练习册系列答案
相关题目
11.下列各项正确的是( )
| 电极反应式 | 出现环境 | |
| A | O2+2H2O+4e-═4OH- | 碱性环境下氢氧燃料电池的负极反应 |
| B | 4OH--4e-═2H2O+O2↑ | 弱酸性环境下钢铁的吸氧腐蚀 |
| C | 2H++2e-═H2↑ | 用惰性电极电解NaOH溶液的阴极反应 |
| D | H2-2e-═2H+ | 用惰性电极电解H2SO4的阳极反应 |
| A. | A | B. | B | C. | C | D. | D |
12.现有部分短周期元素的性质或原子结构如下表:
(1)元素T的原子最外层共有6种不同运动状态的电子.元素X的一种同位素可测定文物年代,这种同位素的符号是14C.
(2)元素Y与氢元素形成一种离子YH${\;}_{4}^{+}$,写出该微粒的电子式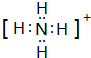 (用元素符号表示).
(用元素符号表示).
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bef.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z原子的价电子数比T原子多
e.Z的最高价氧化物的水化物酸性强于T的最高价氧化物的水化物.
f.Z的单质能与T的氢化物水溶液发生置换反应
(4)Z有多种常见含氧酸,酸性由强到弱的顺序是HClO4>HClO3>HClO.
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y与氢元素形成一种离子YH${\;}_{4}^{+}$,写出该微粒的电子式
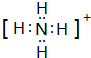 (用元素符号表示).
(用元素符号表示).(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bef.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z原子的价电子数比T原子多
e.Z的最高价氧化物的水化物酸性强于T的最高价氧化物的水化物.
f.Z的单质能与T的氢化物水溶液发生置换反应
(4)Z有多种常见含氧酸,酸性由强到弱的顺序是HClO4>HClO3>HClO.
9.下列有关叙述中正确的是( )
| A. | 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定 | |
| B. | 由碳、氮原子形成的化合物比金刚石硬,其主要原因是碳氮键比碳碳键更短 | |
| C. | S8和NO2都是共价化合物,NH4Cl和CaC2都是离子化合物 | |
| D. | 若ⅡA某元素的原子序数为m,则同周期ⅢA元素的原子序数有可能为m+10 |
1.下列反应既属于氧化还原反应,又是吸热反应的是( )
| A. | 铝与稀盐酸的反应 | |
| B. | 灼热的木炭与CO2反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
18.A、B为前三周期元素,两者组成A2B3型离子化合物,A离子比B离子少一个电子层,已知B的原子序数是x,则A的原子序数是( )
| A. | x-3 | B. | x+3 | C. | x+11 | D. | x-11 |