题目内容
12.现有部分短周期元素的性质或原子结构如下表:| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y与氢元素形成一种离子YH${\;}_{4}^{+}$,写出该微粒的电子式
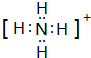 (用元素符号表示).
(用元素符号表示).(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bef.
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.Z原子的价电子数比T原子多
e.Z的最高价氧化物的水化物酸性强于T的最高价氧化物的水化物.
f.Z的单质能与T的氢化物水溶液发生置换反应
(4)Z有多种常见含氧酸,酸性由强到弱的顺序是HClO4>HClO3>HClO.
分析 短周期元素中,T元素原子M层上有2对成对电子,则M层电子排布为3s23p4,故T为S元素;X元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;常温下Y单质为双原子分子,其氢化物水溶液呈碱性,可知Y是N元素;元素Z最高正价是+7价,则Z是Cl,以此解答该题.
解答 解:短周期元素中,T元素原子M层上有2对成对电子,则M层电子排布为3s23p4,故T为S元素;X元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;常温下Y单质为双原子分子,其氢化物水溶液呈碱性,可知Y是N元素;元素Z最高正价是+7价,则Z是Cl.
(1)元素T的最外层电子排布为3s23p4,原子最外层有6个电子,则有6种不同运动状态的电子,元素C的一种同位素可测定文物年代,该同位素含有8个中子,则中子数为6+8=14,这种同位素的符号是14C,
故答案为:6;14C;
(2)元素Y与氢元素形成一种离子NH4+,该微粒的电子式为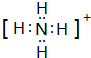 ,
,
故答案为: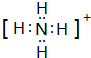 ;
;
(3)S和Cl位于周期表相同周期,Cl元素非金属性较强,可根据氢化物的稳定性、最高价含氧酸的酸性强弱、单质之间相互置换等进行判断,单质都能与氢氧化钠反应、单质状态、原子最外层电子数,都不能用于比较非金属性,
故答案为:Cl;bef;
(4)氯元素有多种常见含氧酸,氯元素化合价越高,含氧酸的酸性越强,常见含氧酸由强到弱的顺序是:HClO4>HClO3>HClO,
故答案为:HClO4>HClO3>HClO.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握金属性、非金属性强弱比较实验事实,难度不大.

练习册系列答案
相关题目
2.下列分子的中心原子形成sp2杂化轨道的是( )
| A. | H2O | B. | NH3 | C. | C2H4 | D. | CH4 |
3.下表为元素周期表的一部分,请回答有关问题:
(1)⑥和⑧的元素符号分别是S、Ar;
(2)表中最活泼的金属是K,非金属最强的元素是F; (填写元素符号)
(3)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色).
(4)比较③、④、⑨三种元素的金属性(或非金属性)强弱K>Mg>Al,判断的依据是(有反应方程式的请写涉及的化学方程式及必要的文字描述)2K+2H2O=2KOH+H2,剧烈反应,Mg+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2,缓慢反应,而金属铝与水在加热条件下反应不明显,结论:金属性K>Mg>Al.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属最强的元素是F; (填写元素符号)
(3)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色).
(4)比较③、④、⑨三种元素的金属性(或非金属性)强弱K>Mg>Al,判断的依据是(有反应方程式的请写涉及的化学方程式及必要的文字描述)2K+2H2O=2KOH+H2,剧烈反应,Mg+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2,缓慢反应,而金属铝与水在加热条件下反应不明显,结论:金属性K>Mg>Al.
1.用一种试剂就能鉴别出乙醇、乙酸、甲酸和葡萄糖四种有机物的水溶液,该试剂是( )
| A. | 银氨溶液 | B. | 金属钠 | ||
| C. | FeCl3溶液 | D. | 新制的Cu(OH)2碱性悬浊液 |
10.下列物质中,属于电解质的是( )
| A. | Cl2 | B. | NaNO3 | C. | SO2 | D. | 硫酸溶液 |
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.