题目内容
6.(1)①常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,该溶液可以是AB.(填选项)A.pH=4的醋酸 B.pH=10的NaOH溶液 C.pH=9的Na2CO3溶液
D.pH=2的硫酸 E.pH=4的NH4Cl溶液
(2)在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则
①该温度下水的离子积常数Kw=1×10-12.
②在该温度下,将100mL 0.1mol/L的稀H2SO4溶液与100mL 0.4mol/L的NaOH溶液混合后,溶液的pH=11.(混合时溶液体积变化忽略不计)
(3)常温下,a mL 0.1mol/L盐酸与b mL 0.1mol/L氨水混合,充分反应.
①写出反应的离子方程式:H++NH3•H2O=NH4++H2O
②若混合后溶液呈中性,则a<b(填“<”、“=”或“>”).
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应.
①两溶液中由水电离出的H+浓度之比为1:1
②若a=b,则反应后溶液中离子浓度从大到小的顺序是c(NH4+)>c(Cl-)>c(OH-)>c(H+).
分析 (1)常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,说明水的电离受抑制,为酸或碱溶液,而氢离子与氢氧根离子浓度之积为1×10-14,据此进行判断;
(2)①Kw=c(H+)•c(OH-)及a+b=12进行计算
②根据混合溶液的酸碱性计算氢离子浓度,从而计算溶液的pH;
(3)①一水合氨与氢离子反应生成铵根离子和水,据此写出反应的离子方程式;
②当a=b时生成氯化铵,溶液为酸性,若为中性,则b应该稍大些;
(4)常温下,a mL pH=3的盐酸与b mL pH=11的氨水混合,充分反应
①常温下,a mL pH=3的盐酸与b mL pH=11的氨水溶液,两溶液中由水电离出的H+浓度均为10-11mol/L;
②若a=b,两者恰好完全反应生成氯化铵和氨水,以氨气的电离为主,溶液呈碱性;
解答 解:(1)常温下,某溶液中由水电离出的c (OH-)=1.0×10-10mol/L,说明水的电离受抑制,为酸或碱溶液,而氢离子与氢氧根离子浓度之积为1×10-14,而pH=2的硫酸溶液中氢离子与氢氧根离子浓度之积为1×10-12,故AB正确,
故答案为:AB;
(2)①Kw=c(H+)•c(OH-)=10-a×10-b=10-(a+b)=1×10-12,
故答案为:1×10-12;
②酸中氢离子的物质的量:0.1mol/L×2×0.1L=0.02mol,碱中氢氧根离子的物质的量为:0.4mol/L×0.1L=0.04mol/L,混合溶液中氢氧根离子浓度为:$\frac{0.04mol-0.02mol}{0.2L}$=0.1mol/L,溶液中氢离子浓度为10-11mol/L,则溶液的pH=11,
故答案为:11;
3)①常温下,a mL 0.1mol/L盐酸与b mL 0.1mol/L氨水混合,充分反应生成氯化铵和水,反应的离子方程式为:H++NH3•H2O=NH4++H2O,
故答案为:H++NH3•H2O=NH4++H2O;
②当a=b时,恰好反应生成氯化铵,铵根离子水解溶液呈酸性,若为中性,则氨水体积应该稍大些,则a小于b,
故答案为:<;
(4)①常温下,a mL pH=3的盐酸与b mL pH=11的氨水溶液,两溶液中由水电离出的H+浓度均为10-11mol/L,则由水电离出的H+浓度之比为1:1,故答案为:1:1;
②若a=b,两者恰好完全反应生成氯化铵和氨水,以氨气的电离为主,溶液呈碱性,离子浓度关系为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+).
点评 本题考查了酸碱混合的定性判断甲基溶液pH的计算、离子浓度定性比较、水的电离及其影响等知识,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系及计算方法,明确判断离子浓度定性常用方法.

| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Ag2S沉淀溶解电离方程式:Ag2S(s)?2Ag+(aq)+S2-(aq) | |
| C. | Fe3O4与稀硝酸溶液反应:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液混合:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
| A. | 银氨溶液 | B. | 金属钠 | ||
| C. | FeCl3溶液 | D. | 新制的Cu(OH)2碱性悬浊液 |
| A. | 11.2g | B. | 5.6g | C. | 33.6g | D. | 22.4g |
| A | ①完全燃烧的产物中n(CO2):n(H2O)=2:1 ②28<M (A)<60 ③不能使溴的四氯化碳溶液褪色 ④一氯代物只有一种结构 |
| B | ①饱和链烃,通常情况下呈气态 ②有同分异构体 ③二溴代物有三种 |
(1)烃A的实验式是CH;
(2)烃A的结构简式是
 ;
;(3)烃B的三种二溴代物的结构简式为CHBr2CH(CH3)2、CH2BrCBr(CH3)2、CH2BrCH(CH3)CH2Br;
(4)烃C为烃B的同系物,常温下为气态且只有一种一溴代物,则烃C的一溴代物的结构简式为CH3Br或CH3CH2Br或(CH3)3CCH2Br(填一种即可).
| A. | 氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2Cl- | |
| B. | 大理石和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液和稀硝酸反应:HCO3-+H+═H2↑+CO32- | |
| D. | 盐酸和氢氧化钾溶液反应:H++OH-═H2O |
| A. | 验证淀粉水解产物时,在淀粉溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量的金属钠 | |
| C. | 向2mLl0%NaOH溶液中滴入2%CuS04溶液的4-6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,则有砖红色沉淀出现 | |
| D. | 植物油能使溴的四氯化碳溶液褪色,盛过油脂的试管用碱液洗涤 |
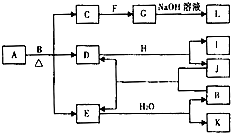 由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题:
由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题: