题目内容
20.工业合成氨与制备硝酸一般可连续生产,流程如图1:
(1)在合成氨的反应中,改变反应条件,会使平衡发生移动.如图2表示随条件改变,氨气的百分含量的变化趋势.
当横坐标为压强时,变化趋势正确的是(选填字母序号)b,
当横坐标为温度时,变化趋势正确的是(选填字母序号)a.
(2)如图3所示三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中充入3mol H2和1mol N2,一定条件下反应,达到平衡时各容器中NH3物质的百分含量由小到大的顺序为①<②<③(填容器编号)
分析 (1)合成氨反应是一个体积减小的反应,可以得出随着压强的增大,平衡向氨气增大的方向移动,结合图象可以知道b符合要求.又因为合成氨反应是一个放热反应,可以得出随着温度的升高,平衡向氨气减少的方向移动,结合图象可以知道a符合要求.
(2)要求三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中充入3mol H2和1mol N2,一定条件下反应,可以知道①是恒温,合成氨是一个放热反应,因此①相当于外界对体系加热,因此加热平衡向氨气减少的方向移动,③活塞可以自由的移动,和外界的大气压强始终保持一致,因合成氨反应是一个压强减少的反应,所以保持压强不变,相当于对体系加压,所以平衡向氨气生成的方向移动.
解答 解:(1)工业合成氨为N2+3H2$?_{高温高压}^{催化剂}$2NH3 △H<0 增大压强时平衡向右进行,氨气的百分含量增大,因△H<0,为放热反应,增加温度,平衡向逆反应方向移动,氨气的百分含量减少,故答案为:b;a;
(2)以②为基准,①外有隔热套,相当于在②基础上加热平衡向逆反应方向移动,氨气的百分含量减少.③是恒压状态,相当于在②基础上加压,平衡向右进行,氨气的百分含量增大.所以NH3物质的百分含量由大到小的顺序为①<②<③,
故答案为:①<②<③.
点评 本题主要考查影响平衡移动的因素和等效平衡原理,难度不大.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
10.下列有关热化学方程式及其叙述正确的是( )
| A. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| B. | 1 mol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,则甲烷的燃烧热化学方程式为:$\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2 (g)+H2O(l)△H=-445 kJ/mol | |
| C. | HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol | |
| D. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0 |
8.关于水的电离平衡,下列叙述正确的是( )
| A. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入稀硫酸,c(H+)增大,水的电离程度增大 | |
| D. | 95℃纯水的pH<7,说明加热可导致水呈酸性 |
15.配制250mL 2mol/L的稀盐酸,需要12.5mol/L的浓盐酸的体积为( )
| A. | 20mL | B. | 40mL | C. | 60mL | D. | 80mL |
5.下列现象或事实不能用同一原理解释的是( )
| A. | Cl2和H2O2都能使品红溶液褪色 | |
| B. | 漂白粉和亚硫酸钠固体长期暴露在空气中变质 | |
| C. | 浓硝酸和氯水用棕色试剂瓶保存 | |
| D. | SO2和Na2SO3溶液都能使溴水褪色 |
9.标准状况下,5.6L某气体的质量为8g,则该气体的相对分子质量是( )
| A. | 64 | B. | 48 | C. | 32 | D. | 16 |
 )
)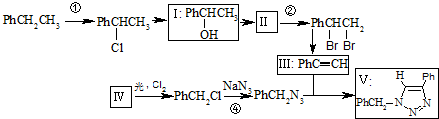
 (不要求写出反应条件).
(不要求写出反应条件).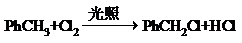 (要求写出反应条件).
(要求写出反应条件).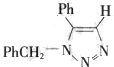 .
.