题目内容
8.关于水的电离平衡,下列叙述正确的是( )| A. | 向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入稀硫酸,c(H+)增大,水的电离程度增大 | |
| D. | 95℃纯水的pH<7,说明加热可导致水呈酸性 |
分析 A.温度不变,水的离子积常数不变;
B.一水合氨电离出氢氧根离子而导致溶液中c(OH-)增大;
C.酸或碱抑制水电离;
D.水的电离是吸热反应,升高温度促进水电离,但水仍然呈中性.
解答 解:A.硫酸氢钠完全电离生成氢离子、钠离子和硫酸根离子,相当于强酸溶液,氢离子浓度增大,但温度不变,水的离子积常数不变,故A正确;
B.一水合氨电离出氢氧根离子而导致溶液中c(OH-)增大,从而抑制水电离,水的电离平衡逆向移动,故B错误;
C.酸或碱抑制水电离,向水中加入稀硫酸,c(H+)增大,抑制水电离,所以水的电离程度减小,故C错误;
D.水的电离是吸热反应,升高温度促进水电离,溶液中氢离子浓度增大,但仍然存在c(H+)=c(OH-),所以水仍然呈中性,故D错误;
故选A.
点评 本题以水的电离为载体考查离子积常数、溶液酸性判断,为高频考点,酸或碱都抑制水电离,含有弱离子的盐促进水电离,注意:水的离子积常数只与温度有关,与溶液酸碱性及浓度无关.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
18.下列说法正确的是( )
| A. | 油脂都能发生皂化反应 | B. | 用裂化汽油来萃取溴水中的溴 | ||
| C. | 糖属于高分子化合物 | D. | 油脂属于高分子化合物 |
16.已知标况下,33.6L CO2含有a个分子,其质量为b g,则阿伏伽德罗常数可表示为( )
| A. | $\frac{2a}{3}$ | B. | $\frac{44a}{b}$ | C. | $\frac{b}{112a}$ | D. | $\frac{a}{56b}$ |
3.下列说法中正确的是( )
| A. | 非自发反应一定不能实现 | |
| B. | 自发反应在任何条件下都能实现 | |
| C. | 同种物质气态时熵值最大,固态时熵值最小 | |
| D. | 放热同时熵减的反应高温下才能自发进行 |
13.选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )
①不溶于水 ②易溶于水 ③比水更容易使碘溶解 ④必须比水密度大
⑤不与碘发生化学反应 ⑥易与碘发生化学反应.
①不溶于水 ②易溶于水 ③比水更容易使碘溶解 ④必须比水密度大
⑤不与碘发生化学反应 ⑥易与碘发生化学反应.
| A. | ①⑤ | B. | ②③④ | C. | ①③⑤ | D. | ①③④⑤ |
17.硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:

请回答下列问题:
(1)补血剂存放时间较长会氧化变质,对滤液中铁元素的存在形式提出如下假设:
假设1:只有Fe2+ 假设2:只有Fe3+
假设3:既有Fe2+又有Fe3+.
(2)如何证明步骤①滤液中含有Fe2+取少量滤液加入试管中,先滴加KSCN溶液,溶液不变色,再滴加氯水(或双氧水、稀硝酸),溶液变为血红色.
(3)步骤④中一系列处理的操作步骤:过滤、洗涤、灼烧、冷却、称量.
(4)该小组有些同学认为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定.
①用离子方程式表示该滴定原理:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需250mL容量瓶.
重复滴定三次,消耗1.00mol/L KMnO4标准溶液体积分别为19.98mL、20.00mL、20.02mL,3次实验所用Fe2+溶液的体积为20.00mL.请根据以上数据,再设计合理数据,完成下列实验过程的记录表格.(必须填满)
③如何判断达到滴定终点:滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,30秒内不恢复.

请回答下列问题:
(1)补血剂存放时间较长会氧化变质,对滤液中铁元素的存在形式提出如下假设:
假设1:只有Fe2+ 假设2:只有Fe3+
假设3:既有Fe2+又有Fe3+.
(2)如何证明步骤①滤液中含有Fe2+取少量滤液加入试管中,先滴加KSCN溶液,溶液不变色,再滴加氯水(或双氧水、稀硝酸),溶液变为血红色.
(3)步骤④中一系列处理的操作步骤:过滤、洗涤、灼烧、冷却、称量.
(4)该小组有些同学认为可用酸化的KMnO4溶液滴定进行Fe2+含量的测定.
①用离子方程式表示该滴定原理:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、量筒、药匙、胶头滴管外,还需250mL容量瓶.
重复滴定三次,消耗1.00mol/L KMnO4标准溶液体积分别为19.98mL、20.00mL、20.02mL,3次实验所用Fe2+溶液的体积为20.00mL.请根据以上数据,再设计合理数据,完成下列实验过程的记录表格.(必须填满)
| 实验编号 | Fe2+溶液的 体积/mL | |||
| 1 | 20.00 | |||
| 2 | 20.00 | |||
| 3 | 20.00 |
3.下列关于乙酸性质的叙述中,正确的是( )
| A. | 乙酸是一种弱酸,不能和碳酸钙反应放出二氧化碳气体 | |
| B. | 乙酸和乙醇在一定条件下发生酯化反应时,乙酸断裂了羟基上的氢 | |
| C. | 乙酸是无色无味的液体 | |
| D. | 乙酸分子中虽然有4个氢原子,但乙酸是一元酸 |
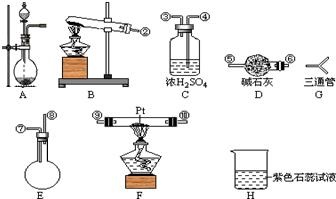 某学生设计氨的催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成.
某学生设计氨的催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成.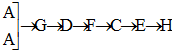 [按装置先后顺序排列]
[按装置先后顺序排列]