题目内容
10.下列有关热化学方程式及其叙述正确的是( )| A. | 氢气的燃烧热为285.8 kJ/mol,则水电解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| B. | 1 mol甲烷完全燃烧生成CO2和H2O(l)时放出890kJ热量,则甲烷的燃烧热化学方程式为:$\frac{1}{2}$CH4(g)+O2(g)=$\frac{1}{2}$CO2 (g)+H2O(l)△H=-445 kJ/mol | |
| C. | HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol | |
| D. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0 |
分析 A、热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,据此分析解答;
B、依据热化学方程式书写方法,标注物质聚集状态和反应焓变写出热化学方程式;
C、HF是弱酸存在电离平衡,电离过程是吸热过程;
D、物质能量越高越活泼.
解答 解:A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H=+285.8kJ•mol-1,故A错误;
B、1mol CH4完全燃烧生成CO2和液态H2O时,放出890kJ热量,甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890kJ/mol,故B错误;
C、HF是弱酸存在电离平衡,电离过程是吸热过程,HF与NaOH溶液反应:HF(aq)+OH-(aq)=H2O(l)+F-(aq)△H>-57.3 kJ/mol,故C错误;
D、物质能量越高越活泼,由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0,故D正确;
故选D.
点评 本题考查了燃烧热,中和热概念的理解应用,物质稳定性和能量的关系分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
18.下列说法正确的是( )
| A. | 油脂都能发生皂化反应 | B. | 用裂化汽油来萃取溴水中的溴 | ||
| C. | 糖属于高分子化合物 | D. | 油脂属于高分子化合物 |
5.下列各组离子在指定的溶液中一定能大量共存的是( )
| A. | 由水电离出的c (OH-)=10-13mol•L-1的溶液中:Na+、Ba2+、Cl-、Br- | |
| B. | c(H+)/c(OH-)=1012的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| C. | 含大量Al3+的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 无色溶液中:K+、Na+、MnO4-、SO42- |
15.${\;}_{2}^{3}$He可作为核聚变材料,以下关于${\;}_{2}^{3}$He的叙述正确的是( )
| A. | ${\;}_{2}^{3}$He原子核内中子数为2 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{1}^{3}$H是同一元素的不同原子 | |
| C. | ${\;}_{2}^{3}$He核外电子数为2 | |
| D. | ${\;}_{2}^{3}$He代表原子核内有2个质子和3个中子的氦原子 |
 .③写出所有符合下列条件的F的同分异构体的结构简式:
.③写出所有符合下列条件的F的同分异构体的结构简式: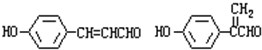 .
.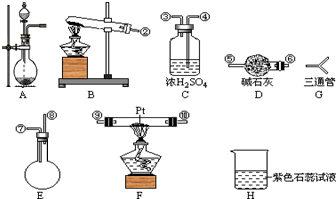 某学生设计氨的催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成.
某学生设计氨的催化氧化实验,并将制得的NO进一步氧化为NO2,用水吸收NO2,并检验HNO3的生成.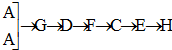 [按装置先后顺序排列]
[按装置先后顺序排列]