题目内容
15.已知:C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol;2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为1:1.家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×105kJ,试写出表示丁烷燃烧热的热化学方程式:C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O△H=-2900kJ/mol.分析 (1)根据物质的量与反应放出的热量成正比,利用热化学反应方程式计算C、H2燃烧放出的热量;
(2)计算丁烷的物质的量,根据反应的化学方程式计算1mol丁烷燃烧放出的热量,可计算反应热并写出热化学方程式.
解答 解:设碳粉xmol,则氢气为(0.2-x)mol,由热化学方程式可知C燃烧放出的热量为393.5xkJ,
H2燃烧放出的热量为241.8(0.2-x)kJ,所以有:
393.5xkJ+241.8(0.2-x)kJ=63.53kJ,
解得x=0.1mol,
则炭粉与H2的物质的量之比为0.1mol:0.1mol=1:1;
10kg丁烷物质的量为$\frac{10000}{58}$mol,完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,所以1mol丁烷完全燃烧生成稳定氧化物时放出的热量为5×105kJ×$\frac{58}{10000}$=2900kJ,表示丁烷燃烧热的热化学方程式:C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O△H=-2900kJ/mol;
故答案为:1:1;C4H10(g)+$\frac{13}{2}$O2(g)═4CO2(g)+5H2O△H=-2900kJ/mol.
点评 本题综合考查反应热的计算以及热化学方程式的书写,为高频考点,侧重于学生的分析、计算能力的考查,注意把握计算的思路以及燃烧热的定义,难度不大.

练习册系列答案
相关题目
3.下列关于乙酸性质的叙述中,正确的是( )
| A. | 乙酸是一种弱酸,不能和碳酸钙反应放出二氧化碳气体 | |
| B. | 乙酸和乙醇在一定条件下发生酯化反应时,乙酸断裂了羟基上的氢 | |
| C. | 乙酸是无色无味的液体 | |
| D. | 乙酸分子中虽然有4个氢原子,但乙酸是一元酸 |
10.关于下列说法:①Fe(OH)3胶体和CuSO4溶液都是混合物;②BaSO4是一种难溶于水的强电解质;③冰醋酸、纯碱、小苏打分别属于酸、碱、盐;④太阳能、氢能和海洋能都属于新能源;⑤置换反应都属于离子反应.其中正确的是( )
| A. | ①②⑤ | B. | ①②④ | C. | ②③④ | D. | ③④⑤ |
20.下列有关物质分类或归类正确的是( )
①混合物:盐酸、塑料、碱石灰
②电解质:胆矾、冰醋酸、氯化铝
③化合物:CaCl2、HD、NaOH
④同分异构体:C60、金刚石、石墨
⑤放热反应:盐酸与氢氧化钠、过氧化氢分解、浓硫酸溶于水.
①混合物:盐酸、塑料、碱石灰
②电解质:胆矾、冰醋酸、氯化铝
③化合物:CaCl2、HD、NaOH
④同分异构体:C60、金刚石、石墨
⑤放热反应:盐酸与氢氧化钠、过氧化氢分解、浓硫酸溶于水.
| A. | ①⑤ | B. | ②④ | C. | ①③ | D. | ①② |
7.下列化学反应对应的离子方程式书写正确的是( )
| A. | 漂白粉溶液在空气中生效:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓ | |
| B. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- | |
| C. | 氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ | |
| D. | 0.01 mol•L-1NH4Al(SO4)2溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O |
4.下列事实与氢键有关的是( )
| A. | 干冰受热升华 | |
| B. | 邻羟基苯甲醛熔沸点小于对羟基苯甲醛熔沸点 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
5.胡椒酚是植物挥发油的成分之一,它的结构简式为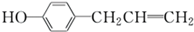 ,下列叙述中不 正确的是( )
,下列叙述中不 正确的是( )
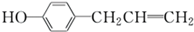 ,下列叙述中不 正确的是( )
,下列叙述中不 正确的是( )| A. | 1 mol胡椒酚最多可与4 mol氢气发生反应 | |
| B. | 1 mol胡椒酚最多可与4 mol溴发生反应 | |
| C. | 胡椒酚可与甲醛发生反应,生成聚合物 | |
| D. | 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |

