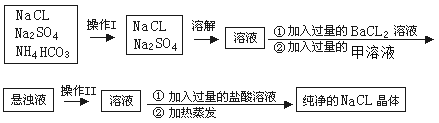
题目内容
【题目】下列说法不正确的是( )
A. 用加热法可除去Na2CO3中的NaHCO3
B. Na2CO3的热稳定性大于NaHCO3
C. 可用石灰水区分Na2CO3与NaHCO3溶液
D. Na2CO3和NaHCO3的水溶液均显碱性
【答案】C
【解析】
A.因2NaHCO3![]() Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,则可用加热法除去Na2CO3固体中的NaHCO3,故A正确;
Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,则可用加热法除去Na2CO3固体中的NaHCO3,故A正确;
B.因2NaHCO3![]() Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,所以Na2CO3的热稳定性大于NaHCO3,故B正确;
Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,所以Na2CO3的热稳定性大于NaHCO3,故B正确;
C.NaHCO3和Na2CO3都可以与石灰水反应生成碳酸钙沉淀,所以不能用石灰水区分Na2CO3与NaHCO3溶液,故C错误;
D.碳酸钠和碳酸氢钠都是强碱弱酸盐,水解后,溶液均显碱性,故D正确;
答案选C。

【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
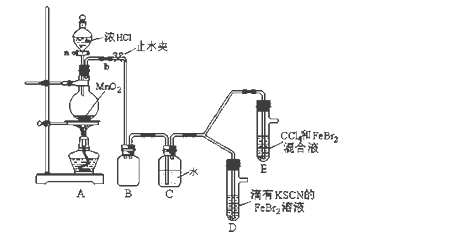
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________