题目内容
【题目】在100mL MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH物质的量和所得沉淀的物质的量的关系如图所示。回答下列问题。
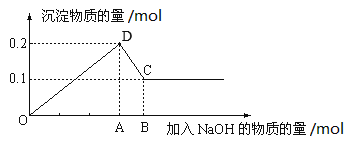
(1)图中CD段反应的化学方程式为___________;C点存在的固体物质为________。
(2)A点的数据为_______;混合液中,MgCl2的浓度为_______。
【答案】Al(OH)3+NaOH=Na[Al(OH)4] Mg(OH)2 0.5mol 1mol/L
【解析】
在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,开始生成氢氧化镁和氢氧化铝沉淀,氢氧化钠过量后氢氧化铝溶解生成四羟基合铝酸钠,结合物质的物质的量以及图象分析计算。
(1)在MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,开始生成氢氧化镁和氢氧化铝沉淀,氢氧化钠过量后氢氧化铝溶解生成四羟基合铝酸钠,则图中CD段反应的化学方程式为Al(OH)3+NaOH=Na[Al(OH)4];氢氧化镁不溶于氢氧化钠溶液中,则C点存在的固体物质为Mg(OH)2。
(2)根据图象可知氢氧化镁是0.1mol,则氢氧化铝是0.2mol-0.1mol=0.1mol,所以根据方程式Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓可知消耗氢氧化钠是0.2mol+0.3mol=0.5mol,即A点的数据为0.5mol;根据镁原子守恒可知混合液中MgCl2的物质的量是0.1mol,浓度为0.1mol÷0.1L=1mol/L。

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目